Абстрактный
Здесь мы сообщаем об расширении химического пространства, доступного для хитина, доступного через биогенные N -платформы 3A5AF, M4A2C и ди-HAF. Биологически активные гетероароматические соединения фуро[3,2- d ]пиримидин-4-он и фуро[3,2- d ]пиримидин-4-амин могут быть селективно доступны из 3A5AF и M4A2C соответственно. Синтон ди-HAF хирального пула является жизнеспособным субстратом для перегруппировки Ахматовича, обеспечивая упрощенный доступ к 2-аминосахарам, имеющим универсальную гидроксиметильную группу в положении C5.
Ключевые слова:
хитин ; ракообразное ; отходы для оценки ; биомасса ; Габеровская независимость ; азотистые гетероциклы ; аминосахар ; платформенные химикаты ; хиральный пул ; фуран
1. Введение
Атом азота (N) в химических веществах тонкого и массового производства получается из товарного аммиака: основного химического вещества, производимого в огромных масштабах с использованием энергоемкого процесса Габера [ 1 , 2 , 3 , 4 ]. Чтобы уменьшить углеродный след азоторганических химикатов, их производство можно проводить независимым от Габера способом, получая азот из огромных количеств биогенного азота, доступного на Земле, причем одним из доступных источников является биополимер хитин [5 , 6 ] . Действительно, несколько сообщений, описывающих превращение хитина (или его мономера, N -ацетил- d -глюкозамина; GlcNAc) в биогенный Nпоявились -платформы [ 7 , 8 , 9 , 10 , 11 , 12 ], включающие функционально богатые фураны 3-ацетамидо-5-фурфуриловый альдегид (3A5F) [ 13 ], 3-ацетамидо-5-ацетилфуран (3A5AF) [ 14 ] и дигидроксиэтилацетамидофуран (ди-HAF) [ 15 ] ( Схема 1 ).
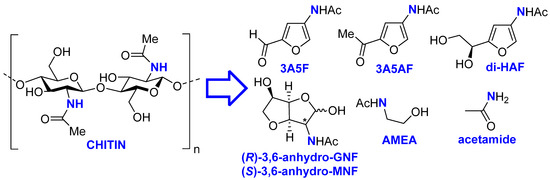
Схема 1. Избранные N -платформы, доступные из хитина.
За последние несколько лет мы продемонстрировали полезность 3A5AF в независимом от Габера синтезе природного продукта проксимицина А [ 16 ], 3-азафуранов [ 17 , 18 ], новых гетероароматических каркасов [ 19 ], 2-аминосахаров [ 20 ]. ] и в программе синтеза, ориентированного на разнообразие (DOS), которая предоставила ряд структурно различных N -гетероциклов [ 21 ]. Недавно мы продемонстрировали, что присущая хитину хиральность может быть перенесена на природный продукт эпи -лептосфаэрин А через платформу хирального пула di-HAF [ 22 ]. Другие исследовательские группы показали, что 3A5AF (и производные) [ 23 ,24 ] и ди-HAF [ 25 ] могут служить диенами в реакции Дильса-Альдера, в то время как 3A5F показал значительные перспективы в качестве химического вещества-платформы, в том числе в качестве средства биоконъюгации для модификации N -цистеина [ 13 ].
Наши постоянные усилия в этой области сосредоточены на использовании вышеупомянутых N -платформ для доступа к химическим промежуточным продуктам, используемым в фармацевтическом и/или агрохимическом секторах. Одной из мишеней, которая соответствует этим критериям, является фуро[3,2- d ]пиримидин-4-амин 1 , гетероароматический каркас, обнаруженный в C -нуклеозидном антибиотике пирролозине [ 26 , 27 , 28 ] и используемый во множестве программ медицинской химии против широкий спектр мишеней, включая тирозинкиназы селезенки [ 29 ], рецептор, связанный с G-белком 119 [ 30 ], киназу p110δ PI3 [ 31]] и фосфоинозитидкиназы FYVE-типа, содержащие палец [ 32 ]. Мы предполагали, что гетероароматическая кольцевая система 1 может быть доступна из 3A5AF посредством цианирования по C2 с последующим гидролизом ацетамида с образованием аминонитрила 2 с последующим гетероаннелированием формамидином [ 27 , 28 , 33 , 34 ] ( схема 2 ). Хотя только один атом азота в 1 получен из хитина, нашей целью было получить другие атомы N из N -соединений, присутствующих в природе ( q.v ).
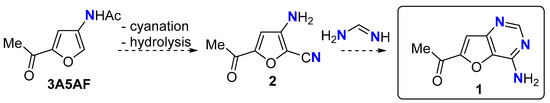
Схема 2. Предлагаемый синтез фуро[3,2- d ]пиримидин-4-амина 1 .
2. Материалы и методы
2.1. Общая информация
Коммерчески доступные исходные материалы, реагенты и растворители использовали в том виде, в котором они были получены, если не указано иное. В случае применения безводных условий реакцию проводили в атмосфере сухого азота в высушенной в печи (100 °C) стеклянной посуде, а растворитель сушили, пропуская через колонку с активированным оксидом алюминия в атмосфере азота с использованием системы очистки растворителя LC Technology. . Тонкослойную хроматографию (ТСХ) проводили с использованием пластин кремнезема F254 толщиной 0,2 мм с последующей визуализацией УФ-облучением при 254 нм и 366 нм и окрашиванием этанольным раствором ванилина. Колоночную флэш-хроматографию проводили с использованием силикагеля 63-100 мкм. Температуры плавления определялись на аппарате Кофлера (John Morris, Новая Зеландия) и не корректировались. Масс-спектры высокого разрешения записаны на масс-спектрометре Bruker micrOTOF Q (Массачусетс, США), работающем в режиме положительных ионов. Для генерации ионов использовался стандартный источник электрораспыления (ESI). Инструмент эксплуатировался в г.м / з 50−1000 дальность. Инфракрасные (ИК) спектры записывали с помощью FTIR-спектрометра PerkinElmer (Массачусетс, США) с установленной универсальной приставкой ослабленного полного отражения (НПВО). Максимумы поглощения выражали в виде волнового числа (см -1 ). Спектры ЯМР записывали при комнатной температуре в растворах CDCl 3 , (CD 3 ) 2 SO или (CD 3 ) 2 CO на ЯМР-спектрометре Bruker (Массачусетс, США), работающем на частоте 400 МГц для ядер 1 H и 100 МГц для ядер 1 H. 13Ядра С. Все химические сдвиги выражались в частях на миллион (м.д.) и измерялись относительно протиевого растворителя, в котором анализировался образец: CDCl 3 ( 7,26 м.д. для 1 Н-ЯМР и δ 77,16 м.д. для 13 С-ЯМР), (CD 3 ) 2 SO ( δ 2,50 м.д. для 1 Н ЯМР и δ 39,52 м.д. для 13 С ЯМР) или (CD 3 ) 2 CO ( δ 2,05 м.д. для 1 Н ЯМР и δ 29,84 м.д. для 13 С ЯМР). Константы связи, Дж, указываются в герцах [Гц], где это применимо. Множественность обозначается как «s» (синглет), «d» (дуплет) и «br s» (широкий синглет). Рентгеноструктурные измерения монокристаллов проводили на монокристаллическом дифрактометре Rigaku Oxford Diffraction XtaLAB-Synergy-S (Токио, Япония) с гибридным пиксельным детектором PILATUS 200K с использованием Cu Kα-излучения (λ = 1,54184 Å). Данные обрабатывались с помощью программных пакетов SHELX2018-3 и Olex2 [ 35 , 36 , 37 ]. Все неводородные атомы уточнены анизотропно. Атомы водорода вводились в расчетные положения или располагались непосредственно и либо уточнялись с помощью модели наездника, либо без ограничений. Меркурий 2020.3.1 [ 38] использовался для визуализации молекулярной структуры. Рост кристаллов для целей рентгеновского кристаллографического анализа достигался с использованием медленного испарения или медленной диффузии пара. Все остальные соответствующие данные содержатся в этой статье и дополнительных материалах .
2.1.1. 2-Гидроксиимино-3-ацетамидо-5-ацетилфуран ( 4 )
К раствору 2-формилфурана 3 [ 18 ] ( 488 мг, 2,5 ммоль) в воде (10 мл) по каплям добавляли раствор гидрохлорида гидроксиламина (195 мг, 2,8 ммоль) и карбоната натрия (148 мг, 1,4 ммоль) в воде (10 мл). метанол (25 мл) при 0°С. Раствор перемешивали при комнатной температуре в течение 2 часов, затем концентрировали в вакууме, разбавляли этилацетатом (80 мл) и промывали водой (40 мл) и солевым раствором (40 мл). Органический слой сушили над Na 2 SO 4 , фильтровали и концентрировали в вакууме. Указанное в заголовке соединение (489 мг, 2,3 ммоль, 93%; д.р. 10:1) использовали на следующей стадии без какой-либо очистки.
2.1.2. 2-Циано-3-ацетамидо-5-ацетилфуран ( 5 )
Раствор оксима 4 (250 мг, 1,2 ммоль) в уксусном ангидриде (5 мл) перемешивали при 50 °С в течение 16 часов. Реакционную смесь концентрировали в вакууме с получением ацетоксииминофурана, который растворяли в ацетонитриле (5 мл). Добавляли триэтиламин (0,50 мл, 3,6 ммоль) и раствор перемешивали при 50°C в течение 2,5 часов. Раствор концентрировали в вакууме и очищали флэш-хроматографией на колонке с силикагелем, элюируя смесью этилацетат-петролейный эфир (2:3), с получением указанного в заголовке соединения (196 мг, 1,0 ммоль , 85%) в виде желтого твердого вещества; т. пл. 126,0–127,5 °С; HRMS [ESI, (M + Na) + ]: вычислено. для [C 9 H 8 N 2 O 3 + Na] + 215,0433, найдено 215,0427𝜈�макс /см -1 (ATR) 3286, 3236, 3088, 2227, 1690, 1559, 1528, 1366, 1276, 1223, 1141, 928; 1 H ЯМР (400 МГц, ацетон- d 6 ): δ 9,86 (1 H, шир. с, NH), 7,67 (1 H, с, ArH), 2,50 (3 H, с, Me), 2,17 (3 H, с, Я); ЯМР 13 С (100 МГц, ацетон- d 6 ): δ 186,7 (С), 169,2 (С), 154,4 (С), 136,8 (С), 111,7 (СН), 111,4 (С), 26,3 (Ме), 23,3 (Me), 1 × C не наблюдалось.
2.1.3. 5-Ацетил-3-амино-2-карбоксамидофуран ( 6 )
К раствору 2-цианофурана 5 (50 мг, 0,26 ммоль) в сухом метаноле (0,6 мл) добавляли раствор HCl в диоксане (4 М, 0,6 мл) при 0 °С. Реакционную смесь перемешивали при 0°C в течение 10 минут, гасили насыщенным раствором NaHCO 3 (15 мл), а затем экстрагировали этилацетатом (3 × 15 мл). Органический слой сушили безводным Na 2 SO 4 , фильтровали и концентрировали в вакууме. Указанное в заголовке соединение (44 мг, 0,26 ммоль, 100%) получали в виде желтого твердого вещества, которое использовали на следующей стадии без какой-либо очистки; т. пл. 192,5–193,5 °С; HRMS [ESI, (M + Na) + ]: вычислено. для [C 7 H 8 N 2 O 3 + Na] +191.0427, найдено 191.0429;𝜈�макс /см -1 (ATR) 3427, 3352, 3152, 1648, 1610, 1570, 1359, 1319, 1194, 940, 775; 1 H ЯМР (400 МГц, ДМСО- d 6 ): δ 7,30 (2 H, шир. с, NH 2 ), 6,86 (1 H, с, ArH), 5,47 (2 H, с, NH 2 ), 2,43 (3 Ч, с, Ме); ЯМР 13 С (100 МГц, ДМСО- d 6 ): δ 187,3 (С), 162,0 (С), 149,3 (С), 141,4 (С), 129,0 (С), 110,2 (СН), 25,8 (Ме).
2.1.4. 6-Ацетилфуро[3,2-d]пиримидин-4-он ( 7 )
Добавляли раствор 2-карбоксамидофурана 6 (20 мг, 0,12 ммоль) в этаноле (4 мл), ацетат формамидина (125 мг, 1,2 ммоль) и реакционную смесь перемешивали при кипячении с обратным холодильником в течение 7 часов. Раствор концентрировали в вакууме, разбавляли этилацетатом (20 мл) и промывали насыщенным раствором Na 2 CO 3 (10 мл) и солевым раствором (10 мл). Органический слой сушили безводным Na 2 SO 4 , фильтровали и концентрировали в вакууме. Остаток очищали флэш-хроматографией на силикагеле, элюируя этилацетатом, с получением указанного в заголовке соединения (7,7 мг, 0,043 ммоль, 36%) в виде желтого масла; HRMS [ESI, (M + Na) + ]: вычислено. для [C 8 H 6 N2 O 3 + Na] + 201,0271, найдено 201,0271; 1 H ЯМР (400 МГц, ДМСО- d 6 ): δ 12,83 (1 H, шир. с, NH), 8,14 (1 H, с, ArH), 7,84 (1 H, с, ArH), 2,57 (3 H, с, Я); ЯМР 13 С (100 МГц, ДМСО- d 6 ): δ 187,7 (С), 154,5 (С), 152,1 (С), 147,3 (С), 147,1 (СН), 139,7 (С), 113,6 (СН), 26,5 (Мне).
2.1.5. Метил 4-ацетамидо-5-формилфуран-2-карбоксилат ( 8 )
Раствор фосфорилхлорида (0,28 мл, 3,0 ммоль) добавляли в сухом диметилформамиде (2,0 мл) при 0°C по каплям к раствору M4A2C [ 16 ] (366 мг, 2,0 ммоль). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 3 часов. Добавляли воду (10 мл) при 0°C и смесь перемешивали еще 10 минут. Водную фазу нейтрализовали NaHCO 3 и экстрагировали этилацетатом (3 × 30 мл), сушили безводным Na 2 SO 4 , фильтровали и концентрировали в вакууме. Остаток очищали флэш-хроматографией на силикагеле, элюируя смесью этилацетат-петролейный эфир (1:1), с получением указанного в заголовке соединения.(262 мг, 1,2 ммоль, 62%) в виде желтого твердого вещества; т. пл. 175,0–176,5 °С; HRMS [ESI, (M + Na) + ]: вычислено. для [C 9 H 9 NO 5 + Na] + 234,0373 найдено 234,0368;𝜈�макс /см -1 (ATR) 3341, 3197, 1754, 1697, 1667, 1590, 1434, 1329, 1219, 1199, 984, 792, 769, 741; 1 H ЯМР (400 МГц, ацетон- d 6 ) δ 9.87 (1 H, с, CH), 9.52 (1 H, шир. с, NH), 7.93 (1 H, с, ArH), 3.93 (3 H, с , Me), 2,24 (3 H, с, Me); ЯМР 13 С (100 МГц, ацетон- d 6 ) δ 181,3 (С), 169,8 (С), 158,8 (С), 147,2 (С), 140,7 (С), 135,0 (С), 113,3 (СН), 52,9 ( Я), 23,9 (Я).
2.1.6. Метил 4-ацетамидо-5-[(гидроксиимино)метил]фуран-2-карбоксилат ( 9 )
К раствору 8 (211 мг, 1,0 ммоль) в метаноле (8 мл) по каплям добавляли раствор гидрохлорида гидроксиламина (83 мг, 1,2 ммоль) и карбоната натрия (64 мг, 0,6 ммоль) в воде (4 мл) при комнатная температура. Реакционную смесь перемешивали при комнатной температуре в течение 1,5 часов. Метанол удаляли в вакууме и реакционную смесь разбавляли этилацетатом (40 мл), а затем промывали водой (20 мл) и солевым раствором (20 мл). Водную фазу экстрагировали этилацетатом (40 мл), объединенные органические фазы сушили безводным Na 2 SO 4 , фильтровали и концентрировали в вакууме. Заглавное соединение (224 мг, 0,99 ммоль, 99%, др.10:1) получали в виде желтого твердого вещества, которое использовали на следующей стадии без дополнительной очистки.
2.1.7. Метил 4-ацетамидо-5-цианофуран-2-карбоксилат ( 10 )
Раствор оксима 9 (226 мг, 1 ммоль) в уксусном ангидриде (3 мл) перемешивали при 70 °С в течение 3 часов. После образования ацетоксииминофурана уксусный ангидрид концентрировали в вакууме. К остатку добавляли ацетонитрил (4 мл) и триэтиламин (0,3 мл, 2 ммоль) и полученный раствор перемешивали при кипячении с обратным холодильником в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении и очищали флэш-хроматографией на силикагеле, элюируя смесью этилацетат-петролейный эфир (1:1), с получением указанного в заголовке соединения (181 мг , 0,87 ммоль, 87%) в виде желтого твердого вещества; т. пл. 219,5–220,5 °С; HRMS [ESI, (M + Na) + ]: вычислено. для [C 9 H 8 N 2 O 4 + Na] +231.0376, найдено 231.0376;𝜈�макс /см -1 (ATR) 3285, 3087, 2229, 1737, 1696, 1533, 1320, 1226, 1149, 985, 815, 769; 1 H ЯМР (400 МГц, ДМСО- d 6 ): δ 10,82 (1 H, с, NH), 7,41 (1 H, с, ArH), 3,86 (3 H, с, Me), 2,10 (3 H, с , Мне); ЯМР 13 С (100 МГц, ДМСО- d 6 ): δ 168,7 (С), 156,9 (С), 145,8 (С), 134,6 (С), 116,1 (С), 112,2 (СН), 111,0 (С), 52,7 (Я), 22,9 (Я).
2.1.8. Метил 4-амино-5-цианофуран-2-карбоксилат ( 11 )
К раствору 10 (62 мг, 0,30 ммоль) в сухом метаноле (3 мл) при 0°C добавляли соляную кислоту (4 М в диоксане, 0,2 мл). Раствор перемешивали при 40°С в течение 6 часов. Реакционную смесь нейтрализовали твердым NaHCO 3 при 0°C с последующим добавлением этилацетата (15 мл) и воды (15 мл). Слои разделяли, водную фазу экстрагировали этилацетатом (2 × 15 мл). Объединенные органические фазы сушили над Na 2 SO 4 , фильтровали и концентрировали в вакууме. Неочищенную смесь очищали флэш-хроматографией на силикагеле, элюируя смесью этилацетат-петролейный эфир (1:1), с получением указанного в заголовке соединения ( 43 мг, 0,26 ммоль, 86%) в виде желтого твердого вещества; т. пл. 165,0–166,0 °С; HRMS [ESI, (M + Na)+ ]: расч. для [C 7 H 6 N 2 O 3 + Na] + 189,0271, найдено 189,0270;𝜈�макс /см -1 (ATR) 3430, 3343, 3232, 2210, 1720, 1607, 1329, 1224, 1176, 765; 1 H ЯМР (400 МГц, ДМСО- d 6 ): δ 6,85 (1 H, с, ArH), 6,17 (2 H, шир. с, NH 2 ), 3,81 (3 H, с, Me); ЯМР 13 С (100 МГц, ДМСО- d 6 ): δ 157,2 (С), 147,0 (С), 145,8 (С), 112,7 (С), 110,8 (СН), 109,1 (С), 52,4 (Ме).
2.1.9. Метил 4-аминофуро[3,2-d]пиримидин-6-карбоксилат ( 12 )
К раствору 4-амино-5-цианофурана 11 (37 мг, 0,22 ммоль) в уксусной кислоте (0,2 мл) добавляли ацетат формамидина (70 мг, 0,69 ммоль) и реакционную смесь перемешивали при кипячении с обратным холодильником в течение 5 ч. . Раствор разбавляли этилацетатом (20 мл), промывали рассолом (10 мл) и насыщали NaHCO 3 (10 мл). Водный слой экстрагировали этилацетатом (2×10 мл), объединенные органические слои сушили над Na 2 SO 4 , фильтровали и концентрировали в вакууме. Остаток очищали флэш-хроматографией на силикагеле, элюируя смесью этилацетат-петролейный эфир (7:3), с получением указанного в заголовке соединения (23 мг, 0,12 ммоль, 54%) в виде бесцветного твердого вещества; т. пл. 218°С (разл.); HRMS [ESI, (M + H) +]: расч. для [C 8 H 7 N 3 O 3 + H] + 194,0560 найдено 194,0564;𝜈�макс /см -1 (ATR) 3434, 3284, 3008, 2960, 1732, 1660, 1301, 1203, 1094, 969, 761; 1 H ЯМР (400 МГц, ДМСО- d 6 ): δ 8,31 (1 H, с, ArH), 7,71 (2 H, шир. с, NH 2 ), 7,67 (1 H, с, ArH), 3,92 (3 H , с, Я); ЯМР 13 С (100 МГц, ДМСО- d 6 ): δ 158,6 (С), 154,5 (СН), 150,4 (С), 148,2 (С), 147,3 (С), 135,4 (С), 113,6 (СН), 52,6 (Мне).
2.1.10. ( R )- N -(5-(2-(( трет- Бутилдиметилсилил)окси)-1-гидроксиэтил)фуран-3-ил)ацетамид ( 15 )
К раствору ди-ГАФ [ 15 ] (55 мг, 0,297 ммоль) в ацетонитриле (3,5 мл) добавляли имидазол (80,9 мг, 1,19 ммоль, 4 экв.) с трет- бутилдиметилсилилхлоридом (42,5 мг, 0,282 ммоль, 0,95 экв.) при комнатной температуре. Реакционную смесь нагревали до 40°С в течение 30 минут и затем концентрировали в вакууме. Остаток очищали флэш-хроматографией, элюируя петролейным эфиром ацетона (5:1), с получением указанного в заголовке соединения (51 мг, 0,170 ммоль, 58%), которое было включено в неразделимую смесь вместе со своим региоизомером (95:5). ; т. пл. 58,6–59,8 °С; HRMS (ESI) m / z [M + Na] + , рассчитано для C 14 H 25 NO 4SiNa 322.1445, найдено 322.1435;𝜈�макс /см -1 (ATR) 3279, 2929, 2857, 1659, 1569, 1463, 1378, 1254, 1119, 1071, 837, 779; 1 H ЯМР (400 МГц, (CD 3 ) 2 CO): δ 9,18 (1 H, шир. с, NH), 7,89 (1 H, с, CH), 6,28 (1 H, с, CH), 4,60 (1 Н, к, J 5,5, СН), 4,35 (1 Н, д, J 5,5, ОН), 3,83 (2 Н, дк, J 5,5, 6,4, СН 2 ), 2,02 (3 Н, с, Ас), 0,87 (9 H, с, (Me) 3 ), 0,05 (3 H, с, Me), 0,04 (3 H, с, Me); ЯМР 13 С (100 МГц, (CD 3 ) 2 CO): δ 162,8 (С), 155,0 (С), 131,2 (СН), 126,7 (С), 102,3 (СН), 69,3 (СН), 67,0 (СН 2), 26,2 (3 × Me), 23,0 (CO Me ), 18,8 (C), -5,2 (Me), -5,3 (Me).
2.1.11. N -((6 R )-6-((( трет- Бутилдиметилсилил)окси)метил)-2-гидрокси-5-оксо-5,6-дигидро-2Н-пиран-3-ил)ацетамид ( 16 )
К раствору 15 (150 мг, 0,501 ммоль) в дихлорметане-метаноле (12 мл: 3 мл) при 0°C добавляли м -CPBA (77%, 123,5 мг, 0,551 ммоль, 1,1 экв.) и проводили реакцию смесь перемешивали при 0°C в течение 2 часов. К раствору добавляли Na 2 CO 3 (15 мл) и перемешивали в течение 30 минут. К реакционной смеси добавляли насыщенный раствор NaHCO 3 (15 мл) и перемешивали еще 30 мин. Смесь экстрагировали этилацетатом (200 мл), промывали холодным Na 2 CO 3 -NaHCO 3 (1:1, 4 × 50 мл), холодным рассолом (2 × 30 мл), сушили (Na 2 SO 4), фильтровали и концентрировали в вакууме. Остаток очищали колоночной флэш-хроматографией на силикагеле, элюируя петролейным эфиром этилацетата (1:1), с получением указанного в заголовке соединения (130 мг, 0,412 ммоль, 82%, др. 1:0,6) в виде бесцветного твердого вещества; т. пл. 145,8–146,8 °С; HRMS (ESI) m/z [M + Na] + , рассчитано для C 14 H 25 NO 5 SiNa 338,1394, обнаружено 338,1385;𝜈�макс /см -1 (ATR) 3290, 2930, 2858, 1719, 1642, 1628, 1518, 1472, 1369, 1228, 1205, 1121, 1043, 958, 872, 825, 780, 729, 708 1 H ЯМР ( 400 МГц, (CD 3 ) 2 CO) Основной диастереомер: δ 9,21 (1 H, шир. с, NH), 6,79 (1 H, с, CH), 5,60 (1 H, с, CH), 4,41 (1 H, q). , J 2,6, CH), 4,00 (2 H, qd, J 4,5, 2,5 CH 2 ), 2,13 (3 H, с, Ac), 0,86 (9 H, с, (Me) 3 ), 0,05 (3 H, с, Me), 0,03 (3 H, с, Me); 13 С ЯМР (100 МГц, (CD 3 ) 2 CO) 195,2 (С), 171,0 (С), 153,5 (С), 108,3 (СН), 89,2 (СН), 76,0 (СН), 64,1 (СН 2 ) , 26,2 ((Я)3 ), 24,6 (Ac), 18,90 ( C (Me) 3 ), -5,1 (SiMe), -5,2 (SiMe); Минорный диастереомер: (400 МГц, (CD 3 ) 2 CO) δ 8,93 (1 H, шир. с, NH), 6,91 (1 H, с, CH), 5,48 (1 H, с, CH), 4,21 (1 H , дд, J 2,8, CH), 4,00 (2 H, qd, J 4,4, 2,7, CH 2 ), 2,17 (3 H, с, Ac), 0,87 (9 H, с, (Me) 3 ), 0,08 ( 3 H, с, Me), 0,05 (3 H, с, Me); ЯМР 13 С (100 МГц, (CD 3 ) 2 CO): δ 194,8 (С), 171,1 (С), 154,3 (С), 109,0 (СН), 89,6 (СН), 80,6 (СН), 64,8 (СН 2 ), 26,1 ((Me) 3 ), 24,7 (Ac), 18,87 (C (Me) 3 ), -5,29 (SiMe), -5,34 (SiMe).
2.1.12. ( R )- N -(6-((( трет- Бутилдиметилсилил)окси)метил)-2,5-диоксо-5,6-дигидро-2 H -пиран-3-ил)ацетамид ( 17 )
К перемешиваемой суспензии целита (1 г) и хлорхромата пиридиния (502 мг, 2,33 ммоль, 2 экв.) в сухом дихлорметане (20 мл) добавляли 16 (367 мг, 1,16 ммоль) одной порцией при 0°C. Смесь нагревали до комнатной температуры и перемешивали в течение 5 часов. Смесь фильтровали через слой целита и концентрировали в вакууме. Остаток очищали колоночной флэш-хроматографией на силикагеле, элюируя петролейным эфиром этилацетата (2:1), с получением указанного в заголовке соединения в виде бесцветного твердого вещества (241 мг, 0,770 ммоль, 66%), т. пл. 112–113,6 °С. ;[ 𝛼 ]23𝐷�Д23+56,0 ( с 0,1, CH 2 Cl 2 ); HRMS (ESI) m / z [M + Na] + , рассчитано для C 14 H 23 NO 5 SiNa 336,1238, найдено 336,1240;𝜈�макс /см -1 (ATR) 3302, 2957, 2930, 2884, 2858, 1708, 1662, 1626, 1485, 1378, 1332, 1299, 1250, 1209, 1109, 1075, 1022, 997, 918, 879, 836, 778, 733; 1 H ЯМР (400 МГц, CDCl 3 ): δ 8,30 (1 H, шир. с, NH), 7,63 (1 H, с, CH), 4,88 (1 H, дд, J 1,7, CH), 4,03 (2 H , dq, CH 2 ), 2,24 (3 H, с, Ac), 0,78 (9 H, с, C(Me) 3 , 0,00 (3 H, с, Si-Me), -0,02 (3 H, с, Si-Me); 13 С ЯМР (100 МГц, CDCl 3 ) δ 192,5 (С), 169,4 (С), 160,2 (С), 138,3 (С), 117,2 (СН), 85,1 (СН), 64,7 (СН 2 ) . ), 25,6 (С Ме 3), 25,0 (Ас), 18,1 (С), -5,6 (Si-Me), -5,7 (Si-Me).
2.1.13. N -((5R , 6R ) -6-((( трет- Бутилдиметилсилил)окси)метил)-5-гидрокси-2-оксо-5,6-дигидро-2Н-пиран-3-ил)ацетамид ( 18 )
Раствор 17 (120 мг, 0,382 ммоль) в дихлорметан-метаноле (1,8:2,6 мл) охлаждали до -78 °C и добавляли трихлорид церия (4,7 мг, 0,0191, 5 моль%), а затем боргидрид натрия (22 мг, 0,574 ммоль, 1,5 экв.). Смесь перемешивали при -78°C в течение 3 часов, а затем экстрагировали этилацетатом (80 мл). Органический слой промывали водой (2×20 мл) и рассолом (20 мл), затем сушили (Na 2 SO 4 ), фильтровали и концентрировали в вакууме. Остаток очищали флэш-хроматографией на колонке с силикагелем, элюируя петролейным эфиром этилацетата (3:1), с получением указанного в заголовке соединения в виде бесцветного твердого вещества (д.р. 93:7) (100 мг, 0,317 ммоль, 83%). т. пл. 144,8–146,0 °С; HRMS (ESI) м / з[M+Na] + , рассчитано для C 14 H 25 NO 5 SiNa 338,1394, найдено 338,1394;𝜈�макс /см -1 (ATR) 3322, 2955, 2930, 2858, 1725, 1671, 1552, 1472, 1384, 1340, 1242, 1191, 1123, 1087, 1006, 974, 941, 895, 835, 77 6, 745, 668; 1 H ЯМР (400 МГц, CDCl 3 ). Основной диастереомер: δ 7,83 (1 H, с, NH), 7,65 (1 H, д, J 6,8, CH), 4,54 (1 H, дд, J 2,5, CH), 4,54 (1 H, дд, J 2,5, CH), 4,41 (1 H, дк, J 2,5, 1,1, CH), 4,03 (2 H, дк, J 6,5, 5,3, CH 2 ), 2,14 (3 H, с, Ac), 0,91 (9 H, с, C( Me) 3 ), 0,121 (3 H, с, Si-Me), 0,117 (3 H, с, Si-Me), OH не наблюдается; 13 С ЯМР (100 МГц, CDCl 3 ): δ169,4 (С), 162,1 (С), 127,1 (С), 121,2 (СН), 79,8 (СН), 61,9 (СН 2 ), 61,8 (СН), 25,9 (3 х Ме), 24,7 (Ас), 18,3 ( C (Me) 3 ), -5,3 (Si-Me), -5,4 (Si-Me).
3. Результаты и их обсуждение
Фурфурол 3, полученный из 3A5AF [ 18 ], был превращен в оксим 4 (без очистки), что после дегидратации позволило получить 2-циано-3A5AF 5 с превосходным выходом в течение трех стадий (Схема 3 ) . По нашему опыту, гидролиз ацетамидом производных 3A5AF протекает плохо в водных условиях, что часто приводит к значительному разложению из-за требуемых повышенных температур. Мы обнаружили, что метанолиз, опосредованный безводной кислотой, более надежен, поскольку он протекает при более низких температурах. Метанолиз ацетамида оказался успешным с получением 6, но спектроскопический анализ ЯМР показал, что также происходил гидролиз нитрила, которому способствовала вода, образующаяся при реакции HCl с MeOH. Несмотря на этот непредсказуемый результат, мы подвергли6 к гетероаннеляции с формамидином с получением фуро[3,2- d ]пиримидин-4-она с 7 . Хотя фуро[3,2- d ]пиримидин-4-оны не были первоначально намеченной мишенью, они нашли применение в медицинских программах, нацеленных на белок веретена кинезина [ 39 ] и убиквитиновую протеасомную систему 7 (USP7) [ 40 ].
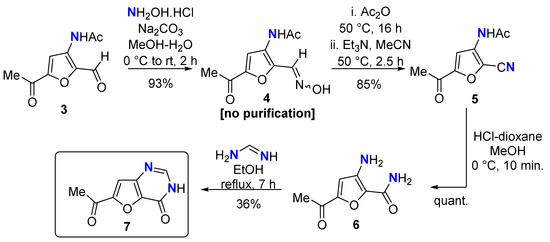
Схема 3. Синтез фуро[3,2- d ]пиримидин-4-она 7 .
Первоначальный план имел ограничения, поскольку мы не ожидали легкого гидролиза нитрила в 5 . В поисках первоначальной цели — фуро[3,2- d ]пиримидин-4-аминного каркаса — в качестве субстрата было выбрано производное аминокислоты хитина метил-4-ацетамидофуран-2-карбоксилат (M4A2C) [ 16 ]. что сложный эфир с меньшим электроноакцептором снижает реакционную способность нитрила, делая его менее восприимчивым к гидролизу ( Схема 4 А). Формилирование M4A2C по Вильсмайеру привело к образованию фурфурола 8 , который был превращен в 2-цианофуран 10 (через оксим 9) с отличным общим выходом. Влияние эфира на M4A2C было убедительным; метанолиз избирательно расщепил ацетамид в 9 , оставив цианогруппу нетронутой. Наконец, гетероаннеляция формамидином привела к образованию фуро[3,2- d ]пиримидин-4-амина 12 . В продуктах 7 и 12 только один атом азота получен из хитина. Однако гидроксиламин можно считать биогенным; он является продуктом процесса нитрификации и широко распространен в природе [ 41 ]. Формамидин доступен из природного продукта цианамида [ 42 , 43 ], который сам биосинтезируется из аминокислоты L -канаванина [42, 43].44 ] ( схема 4 Б). Также возможно, что биогенный формамидин может быть получен при превращении мочевины в тиомочевину с последующей восстановительной десульфуризацией [ 45 ].
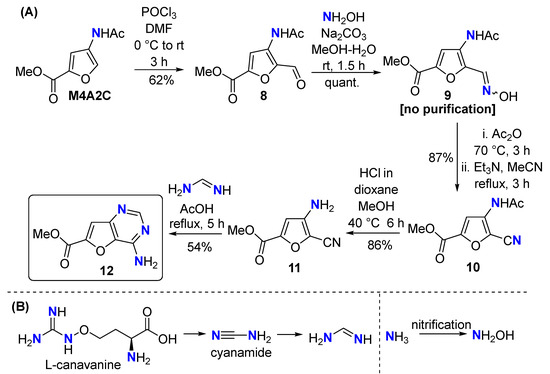
Схема 4. ( А ) Синтез фуро[3,2- d ]пиримидин-4-амина 12 из M4A2C; ( Б ) формамидин и гидроксиламин представляют собой N -соединения, существующие в природе.
Синтез фуро[3,2- d ]пиримидин-4-амина 12 и фуро[3,2- d ]пиримидин-4-она 7 из 3A5AF расширил гетероароматическое химическое пространство, доступное из хитина. Мы также хотели бы сообщить о наших предварительных результатах по расширению окислительного кольца синтона хирального пула ди-HAF. Ранее мы сообщали о синтезе энантиообогащенных 2-аминосахаров из 3A5AF [ 20 ]; однако этот метод имеет некоторые недостатки ( схема 5 А). Введение искусственной хиральности с использованием восстановления Нойори было затруднительным (50 °C, время реакции 1 неделя) при получении фурфурилового спирта 13, так как при расширении окислительного кольца он давал N -ацетил -l .-красноносый (RedNAc). Отсюда было доступно несколько 2-аминосахаров, но все они содержали метильную группу в С5, которая ограничивала модификации в этом сайте. Ожидалось, что эти недостатки можно будет преодолеть, если полученный из хитина синтон ди-HAF хирального пула успешно подвергнется реакции Ахматовича; не только природная хиральность, присутствующая в хитине, будет передана продукту (таким образом устраняя необходимость восстановления Нойори), но и полученный 2-аминосахар 14 будет обладать универсальной гидроксиметильной группой в положении C5 ( схема 5 B). Более того, 14 представляет собой новый каркас из 2-аминосахаров, который может быть сложно получить из N -ацетил- d -глюкозамина (GlcNAc) [ 46 ,47 , 48 , 49 ].
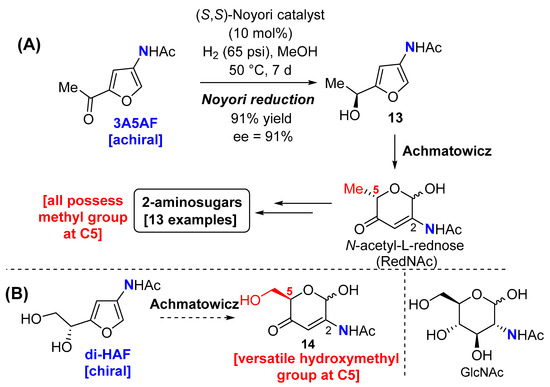
Схема 5. ( А ) Синтез 2-аминосахаров из 3A5AF; ( B ) Предполагаемое окислительное расширение кольца ди-HAF. Структура GlcNAc показана для сравнения.
Чтобы облегчить обращение с ожидаемыми продуктами, ди-HAF был моносилилирован по первичному спирту с получением 15 , а также небольших количеств его региоизомера, который нельзя было разделить с помощью колоночной хроматографии ( схема 6 ). Перегруппировка Ахматовича прошла гладко и привела к получению несколько нестабильного 2-аминосахара 16 с хорошим выходом. Окисление лактола помогло стабилизировать каркас, давая дион 17 . Восстановление Luche в C4-кетоне обеспечило 18 с хорошей диастереоселективностью, а структура основного син- диастереомера была подтверждена рентгеноструктурным анализом ( рис. 1 ).
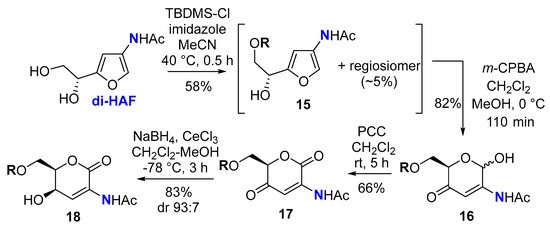
Схема 6. Применение ди-HAF в перегруппировке Ахматовича ( R = трет -бутилдиметилсилил; TBDMS).
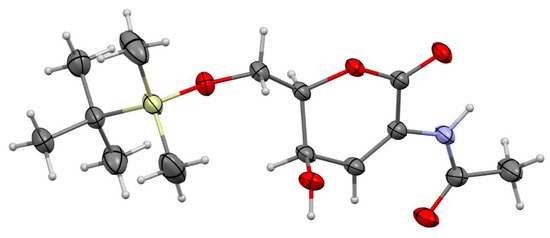
Рисунок 1. Молекулярная структура 2-аминосахара 18 (CCDC 2285900). Параметры смещения атомов были нарисованы с уровнем вероятности 50%.
В заключение можно сказать, что доступ к дополнительному биогенному N -химическому пространству осуществляется с хитиновых платформ 3A5AF, M4A2C и di-HAF. Высокоценные гетероароматические каркасы фуро[3,2- d ]пиримидин-4-он 7 и фуро[3,2- d ]пиримидин-4-амин 12 могут быть селективно получены из биогенных N -платформ 3A5AF и M4A2C соответственно. . Более того, хиральный каркас ди-HAF является жизнеспособным субстратом для перегруппировки Ахматовича, генерируя новые, энантиообогащенные 2-аминосахарные химические вещества, обладающие хиральными центрами, которые можно проследить до биополимера хитина, при этом все продукты обладают универсальной 5-гидроксиметильной ручкой в С5.
Дополнительные материалы
Следующую вспомогательную информацию можно загрузить по адресу: https://www.mdpi.com/article/10.3390/chemistry5030135/s1 . Спектры ЯМР всех новых соединений и данные рентгеноструктурного анализа 18 .
Вклад автора
Концептуализация, JS; Методология, TAR, JCN и SPJ; Валидация, JCN; Формальный анализ, TAR, JCN, SPJ и TS; Расследование, TAR, JCN и SPJ; Курирование данных, TAR, SPJ, TS и JS; Написание — оригинальный черновик, JS; Супервизия, JS; Администрирование проекта, JS; Приобретение финансирования, JS и JCN. Все авторы прочитали и согласились с опубликованной версией рукописи.
Финансирование
Мы благодарим Оклендский университет за присуждение докторской стипендии (JCN).
Заявление о доступности данных
Кристаллографические данные для 2-аминосахара 18 , представленные в этой статье, депонированы в Кембриджском центре структурных данных под номером депонирования CCDC 2285900. Копии данных можно получить бесплатно через https://www.ccdc.cam.ac. uk/structures/ (по состоянию на 7 августа 2023 г.). Все остальные соответствующие данные содержатся в этой статье и дополнительных материалах .
Благодарности
Мы благодарны Тимоти Кристоферу за сбор данных рентгеноструктурного анализа монокристаллов.
Конфликт интересов
Авторы объявили, что нет никаких конфликтов интересов.
Рекомендации
- Кириаку, В.; Гарагунис, И.; Вуррос, А.; Василейу, Э.; Стукидес, М. Электрохимический процесс Габера-Боша. Джоуль 2020 , 4 , 142–158. [ Академия Google ] [ CrossRef ]
- Песня, X.; Башир, К.; Заре Р.Н. Получение аммиака из микрокапель азота и воды. Учеб. Натл. акад. наук. США 2023 , 120 , e2301206120. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Соловейчик Г. Электрохимический синтез аммиака как потенциальная альтернатива процессу Габера – Боша. Нат. Катал. 2019 , 2 , 377–380. [ Академия Google ] [ CrossRef ]
- Ван, М.; Хан, Массачусетс; Мохсин, И.; Уикс, Дж.; ИП, АХ; Сумон, Казахстан; Динь, Коннектикут; Сарджент, Э. Х.; Гейтс, ID; Голам Кибрия, М. Могут ли устойчивые пути синтеза аммиака конкурировать с процессами Габера-Боша на основе ископаемого топлива? Энергетическая среда. наук. 2021 , 14 , 2535–2548. [ Академия Google ] [ CrossRef ]
- Ян, Н.; Чен, X. Устойчивое развитие: не выбрасывайте отходы морепродуктов. Природа 2015 , 524 , 155–157. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Халси, MJ; Ян, Х.; Ян, Н. Устойчивые пути синтеза возобновляемых химикатов, содержащих гетероатомы. АСУ Сустейн. хим. англ. 2018 , 6 , 5694–5707. [ Академия Google ] [ CrossRef ]
- Дай, Дж.; Ли, Ф.; Фу, X. На пути к биопереработке Shell: достижения в химико-каталитической конверсии хитиновой биомассы в азоторганические химикаты. ChemSusChem 2020 , 13 , 6498–6508. [ Академия Google ] [ CrossRef ]
- Осада, М.; Кикута, К.; Ёсида, К.; Тотани, К.; Огата, М.; Усуи, Т. Некаталитический синтез хромогенов I и III из N-ацетил-D-глюкозамина в высокотемпературной воде. Зеленая химия. 2013 , 15 , 2960–2966. [ Академия Google ] [ CrossRef ]
- Течикавара, К.; Кобаяши, Х.; Фукуока, А. Превращение N-ацетилглюкозамина в защищенную аминокислоту на катализаторе Ru/C. АСУ Сустейн. хим. англ. 2018 , 6 , 12411–12418. [ Академия Google ] [ CrossRef ]
- Боббинк, Флорида; Чжан, Дж.; Пирсон, Ю.; Чен, X.; Ян, Н. Превращение производного хитина N-ацетил-D-глюкозамина (NAG) в полиолы с использованием катализаторов на основе переходных металлов и водорода в воде. Зеленая химия. 2015 , 17 , 1024–1031. [ Академия Google ] [ CrossRef ]
- Никахд, М.; Микусек, Дж.; Ю, Л.-Ж.; Кут, ML; Банвелл, Миннесота; Ма, К.; Гардинер, М.Г. Использование хитина как источника биологически фиксированного азота: образование и полная характеристика низкомолекулярных гетеро- и карбоциклических продуктов пиролиза. Дж. Орг. хим. 2020 , 85 , 4583–4593. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Банвелл, Миннесота; Поллард, Б.; Лю, X.; Коннал, Лос-Анджелес. Использование самых распространенных в природе полимеров: разработка новых путей преобразования целлюлозы, гемицеллюлозы, лигнина и хитина в платформенные молекулы (и за их пределами). хим. Азиатский журнал, 2021 , 16 , 604–620. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Гомес, РФА; Гонсалвеш, BMF; Андраде, KHS; Соуза, BB; Маулид, Н.; Бернард, GJL; Афонсо, CAM Раскрытие потенциала фурановых платформ на биологической основе, богатых азотом, в качестве синтонов биомассы. Энджью. хим. Межд. Эд. 2023 , 62 , e202304449. [ Академия Google ] [ CrossRef ]
- Падован, Д.; Кобаяши, Х.; Фукуока, А. Простое получение 3-ацетамидо-5-ацетилфурана из N-ацетил-d-глюкозамина с использованием коммерчески доступных солей алюминия. ChemSusChem 2020 , 13 , 3594–3598. [ Академия Google ] [ CrossRef ] [ PubMed ]
- ван дер Лоо, CHM; Борст, MLG; Паувер, К.; Миннаард, А.Дж. Дегидратация N-ацетилглюкозамина (GlcNAc) до энантиочистого дигидроксиэтилацетамидофурана (Di-HAF). Орг. Биомол. хим. 2021 , 19 , 10105–10111. [ Академия Google ] [ CrossRef ]
- Садик, AD; Чен, X.; Ян, Н.; Сперри, Дж. На пути к биоперерабатывающему заводу Shell: устойчивый синтез противоракового алкалоида проксимицина А из хитина. ChemSusChem 2018 , 11 , 532–535. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Фам, ТТ; Линдси, AC; Чен, X.; Гезайдин, Г.; Ян, Н.; Сперри, Дж. Перенос биовозобновляемого азота, присутствующего в хитине, в несколько N-функциональных групп. Поддерживать. хим. Фарм. 2019 , 13 , 100143. [ Академия Google ] [ CrossRef ]
- Фам, ТТ; Линдси, AC; Ким, Южный-Западный; Перселло, Л.; Чен, X.; Ян, Н.; Сперри, Дж. Двухэтапное получение разнообразных 3-амидофуранов из хитина. ChemistrySelect 2019 , 4 , 10097–10099. [ Академия Google ] [ CrossRef ]
- Фам, ТТ; Чен, X.; Ян, Н.; Сперри, Дж. Новый дигидродифуропиридиновый каркас, полученный из кетонов и гетероцикла, полученного из хитина, 3-ацетамидо-5-ацетилфурана. Монатш. хим. 2018 , 149 , 857–861. [ Академия Google ] [ CrossRef ]
- Фам, ТТ; Гезайдин, Г.; Зёнель, Т.; Ян, Н.; Сперри, Дж. Окислительное расширение кольца платформы, полученной из хитина, обеспечивает доступ к неизведанному химическому пространству 2-аминосахаров. Евро. Дж. Орг. хим. 2019 , 2019 , 1355–1360. [ Академия Google ] [ CrossRef ]
- Фам, ТТ; Чен, X.; Зёнель, Т.; Ян, Н.; Сперри, Дж. Хабер-независимый, ориентированный на разнообразие синтез азотных соединений из биовозобновляемого хитина. Зеленая химия. 2020 , 22 , 1978–1984. [ Академия Google ] [ CrossRef ]
- Невилл, Джей Си; Лау, МОЙ; Зёнель, Т.; Сперри, Дж. Хабер-Независимый асимметричный синтез морского алкалоида эпи-лептосферина из синтона хирального пула, полученного из хитина. Орг. Биомол. хим. 2022 , 20 , 6562–6565. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Перейра, Дж.Г.; Раваско, JMJM; Вейл, младший; Кведа, Ф.; Гомес, RFA Прямая реакция Дильса-Альдера с получением 3-ацетамидо-5-ацетилфурана из хитина. Зеленая химия. 2022 , 24 , 7131–7136. [ Академия Google ] [ CrossRef ]
- Сантос, CS; Родини Маттиоли, Р.; Соарес Баптиста, Ж.; Менезес да Силва, В.Х.; Браун, DL; Пастре, Дж. К. Азотированные ароматические соединения из хитина. Зеленая химия. 2023 , 25 , 5059–5067. [ Академия Google ] [ CrossRef ]
- ван дер Лоо, CHM; Шим ван дер Лофф, Р.; Мартин, А.; Гомес-Сал, П.; Борст, MLG; Паувер, К.; Миннаард, А.Дж. π-фациальная селективность в реакции Дильса-Альдера хиральных фуранов и малеимидов на основе глюкозамина. Орг. Биомол. хим. 2023 , 21 , 1888–1894. [ Академия Google ] [ CrossRef ]
- Икегами, С.; Исомура, Х.; Цучимори, Н.; Хамада, К.; КОБАЯСИ, Х.; Кодзима, Ю.; Осано, Ю.Т; Кумадзава, С.; Мацузаки, Т. Кристаллическая структура ингибитора эмбрионального развития морских звезд, 4-оксо-7-(β-D-рибофуранозил)-3H-фуро[3, 2-d]пиримидин: пересмотр структуры пирролозина. Анальный. наук. 1992 , 8 , 897–898. [ Академия Google ] [ CrossRef ]
- Бхаттачарья, БК; Лим, М.-И.; Выдра, бакалавр искусств; Кляйн, Р.С. Синтез фуро[3,2-d]пиримидиновых нуклеозидов: новый c-нуклеозидный изостер аденозина. Тетраэдр Летт. 1986 , 27 , 815–818. [ Академия Google ] [ CrossRef ]
- Бхаттачарья, БК; Выдра, бакалавр искусств; Беренс, РЛ; Кляйн, Р.С. Исследования по синтезу фуро[3,2-d]пиримидин-С-нуклеозидов: новые аналоги инозина с антипротозойной активностью. Нуклеозиды Нуклеотиды 1990 , 9 , 1021–1043. [ Академия Google ] [ CrossRef ]
- Хоеманн, М.; Уилсон, Н.; Аргириади, М.; Банах, Д.; Бурчат, А.; Колдервуд, Д.; Клэпхэм, Б.; Кокс, П.; Дуиньян, Д.Б.; Конопацкий, Д.; и другие. Синтез и оптимизация фурано[3,2-d]пиримидинов как селективных ингибиторов тирозинкиназы селезенки (Syk). Биоорг. Мед. хим. Летт. 2016 , 26 , 5562–5567. [ Академия Google ] [ CrossRef ]
- Кошизава, Т.; Моримото, Т.; Ватанабэ, Г.; Ватанабэ, Т.; Ямасаки, Н.; Савада, Ю.; Фукуда, Т.; Окуда, А.; Сибуя, К.; Огия, Т. Оптимизация новой серии мощных и перорально биодоступных агонистов GPR119. Биоорг. Мед. хим. Летт. 2017 , 27 , 3249–3253. [ Академия Google ] [ CrossRef ]
- Хэнкокс, Техас; Пегг, Северная Каролина; Надин, Эй Джей; Прайс, С. Фармацевтические соединения. Патент WO2008152394, 12 июня 2008 г. [ Google Scholar ]
- Роудс, Дж.; Майдолл, М.; Цой, И.Ю.; Копец Б. Методы и лечение вирусной инфекции замещенными фуро-пиримидинами. Патент WO2022261068, 8 июня 2021 г. [ Google Scholar ]
- Ким, С.; Хонг, Дж. Х. Синтез новых 4'-трифторметил-5'-норкарбоциклических C-нуклеозидфосфоновых кислот в качестве мощных противолейкемических средств. Нуклеозиды Нуклеотиды Нуклеиновые Кислоты 2015 , 34 , 848–865. [ Академия Google ] [ CrossRef ]
- Бутора, Г.; Олсен, Д.Б.; Кэрролл, СС; МакМастерс, доктор медицинских наук; Шмитт, К.; Леоне, Дж. Ф.; Сталхут, М.; Бурлейн, К.; МакКосс, М. Синтез и ингибирующие ВГС свойства 9-деаза- и 7,9-дидеаза-7-окса-2'-C-метиладенозина. Биоорг. Мед. хим. 2007 , 15 , 5219–5229. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Шелдрик, генеральный директор Краткая история SHELX. Акта Кристаллогр. Секта. А, 2008 , 64 , 112–122. [ Академия Google ] [ CrossRef ]
- Бурхис, LJ; Доломанов О.В.; Гильдеа, Р.Дж.; Ховард, JAK; Пушманн, Х. Анатомия комплексной ограниченной программы усовершенствования современной вычислительной среды - анализ Olex2. Акта Кристаллогр. Секта. А 2015 , 71 , 59–75. [ Академия Google ] [ CrossRef ]
- Доломанов О.В.; Бурхис, LJ; Гильдеа, Р.Дж.; Ховард, JAK; Пушманн, Х. OLEX2: Полное структурное решение, программа уточнения и анализа. Дж. Прил. Кристаллогр. 2009 , 42 , 339–341. [ Академия Google ] [ CrossRef ]
- Макрэ, CF; Соваго, И.; Коттрелл, С.Дж.; Галек, ОТА; Маккейб, П.; Пидкок, Э.; Платингс, М.; Шилдс, врач общей практики; Стивенс, Дж. С.; Таулер, М.; и другие. Меркурий 4.0: от визуализации к анализу, проектированию и прогнозированию. Дж. Прил. Кристаллогр. 2020 , 53 , 226–235. [ Академия Google ] [ CrossRef ]
- Теоклиту, М.-Э.; Акила, Б.; Блок, Миннесота; Бразил, ПиДжей; Кастриотта, Л.; Код, Э.; Коллинз, член парламента; Дэвис, AM; Диган, Т.; Эжутачан, Дж.; и другие. Открытие (+)-N-(3-аминопропил)-N-[1-(5-бензил-3-метил-4-оксо-[1,2]тиазоло[5,4-d]пиримидин-6-ил )-2-метилпропил]-4-метилбензамид (AZD4877), ингибитор белка кинезинового веретена и потенциальный противораковый агент. Дж. Мед. хим. 2011 , 54 , 6734–6750. [ Академия Google ] [ CrossRef ] [ PubMed ]
- О'Дауд, ЧР; Хелм, доктор медицины; Раунтри, JSS; Флаз, Дж. Т.; Аркудис, Э.; Миэль, Х.; Хьюитт, PR; Джордан, Л.; Баркер, О.; Хьюз, К.; и другие. Идентификация и структурно-ориентированная разработка ингибиторов USP7 на основе пиримидинона. АКС Мед. хим. Летт. 2018 , 9 , 238–243. [ Академия Google ] [ CrossRef ]
- Чжан, Д.; Ли, В.; Хуанг, X.; Цинь, В.; Лю, М. Удаление аммония из поверхностных вод при низкой температуре недавно выделенной микробактерией Sp. Штамм SFA13. Биоресурс. Технол. 2013 , 137 , 147–152. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Одо, К.; Итикава, Э.; Шираи, К.; Сугино, К. Примечания — новый метод получения формамидина. Дж. Орг. хим. 1957 , 22 , 1715. [ Google Scholar ] [ CrossRef ]
- Камо, Т.; Хирадате, С.; Фуджи, Ю. Первое выделение природного цианамида как возможного аллелохимического вещества из вики волосатой Vicia Villosa. Дж. Хим. Экол. 2003 , 29 , 275–283. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Камо, Т.; Сакурай, С.; Яманаси, Т.; Тодороки, Ю. Цианамид биосинтезируется из L-канаванина в растениях. наук. Rep. 2015 , 5 , 10527. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Браун, DJ Новый синтез формамидина. Дж. Прил. хим. 1952 , 2 , 202–203. [ Академия Google ] [ CrossRef ]
- Пфрэнгл, Ф.; Рейссиг, Х.-У. Аминосахара и их миметики через 1,2-оксазины. хим. Соц. Ред. 2010 г. , 39 , 549–557. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Эммади, М.; Кулкарни, С.С. Последние достижения в синтезе бактериальных строительных блоков редких сахаров и их применения. Нат. Прод. Республика 2014 , 31 , 870–879. [ Академия Google ] [ CrossRef ]
- Скарбек, К.; Милевска, М.Дж. Биосинтетический и синтетический доступ к аминосахарам. Углевод. Рез. 2016 , 434 , 44–71. [ Академия Google ] [ CrossRef ]
- Ян, Дж.; Се, Д.; Ма, X. Последние достижения в химическом синтезе аминосахаров. Молекулы 2023 , 28 , 4724. [ Академика Google ] [ CrossRef ]
