- Категория: Блог
- Просмотров: 537
2. Материалы и методы
2.1. Растительный материал
2.2. Процедура ПФЛП
2.3. Индекс регенерации

2.4. Сбор данных и статистический анализ данных AFLP
2.5. Информация о среде обитания 91E0*
3. Результаты
3.1. Генетические результаты

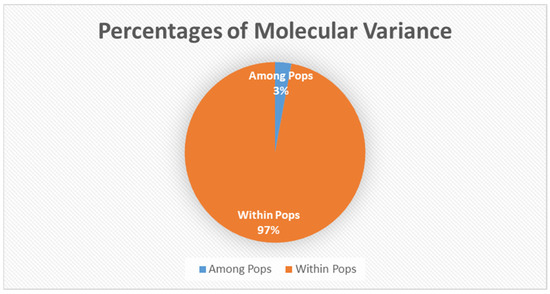
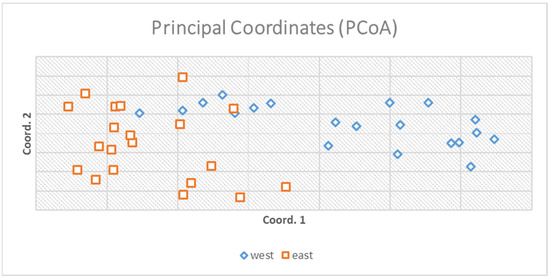
3.2. Плотность и индекс регенерации

4. Дискуссия
5. Выводы
Вклад автора
Финансирование
Заявление о доступности данных
Конфликт интересов
Рекомендации
- Ричардсон, DM; Пышек, П.; Рейманек, М.; Барбур, Миннесота; Панетта, Флорида; Уэст, К.Дж. Натурализация и вторжение чужеродных растений: концепции и определения. Дайверы. Распредел. 2000 , 6 , 93–107. [ Академия Google ] [ CrossRef ]
- Коракаки, Э.; Легакис, А.; Кацаневакис, С.; Кулелис, П.; Аврамиду, Э.; Сулиоти, Н.; Петракис, П. Инвазивные чужеродные виды Греции. Обсервация инвазивных чужеродных видов. Проблемы вокруг света 2021 , 3 , 124–189. [ Академика Google ]
- Мияваки, С.; Вашитани, И. Инвазивные чужеродные виды растений в прибрежных районах Японии: вклад сельскохозяйственных сорняков, видов восстановления растительности и аквакультурных видов. Глоб. Окружающая среда. Рез.-англ. Эд. 2004 , 8 , 89–101. [ Академика Google ]
- Каллауэй, РМ; Ашехуг, Э.Т. Инвазивные растения против их новых и старых соседей: механизм экзотического вторжения. Наука 2000 , 290 , 521–523. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Иванеску, Б.; Лунгу, К.; Власе, Л.; Градинару, AC; Тухилус, К. ВЭЖХ-анализ фенольных соединений, антиоксидантной и противомикробной активности Amorpha fruticosa L. Экстракты. Дж. Плант Дев. 2019 , 26 , 77. [ Академия Google ] [ CrossRef ]
- Штрауб, Южная Каролина; Извините, бакалавр; Уикли, А.С. Amorpha confusa , новое название старой Amorpha (Fabaceae: Amorpheae). Дж. Бот. Рез. Инст. Техас, 2009 г. , 151–155. [ Академика Google ]
- Штрауб, Южная Каролина; Дойл, Дж. Дж. Молекулярная филогенетика Amorpha (Fabaceae): оценка монофилии, видовых отношений и полиплоидного происхождения. Мол. Филогенетика Эвол. 2014 , 76 , 49–66. [ Академия Google ] [ CrossRef ]
- Лю, Дж.; Ван, ET; Chen, WX Разнообразные ризобии, связанные с древесными бобовыми культурами Wisteria sinensis , Cercis Racemosa и Amorpha fruticosa, выращиваемыми в умеренной зоне Китая. Сист. Прил. Микробиол. 2005 , 28 , 465–477. [ Академия Google ] [ CrossRef ]
- Китайский, П. Словарь китайской Materia Medica ; Китайская научно-техническая медицинская пресса: Пекин, Китай, 1997. [ Google Scholar ]
- Митчер, Луизиана; Парк, Ю.Х.; Альшамма, А.; Хадсон, ПБ; Хаас, Т. Аморфрутин a и b, бибензиловые противомикробные средства из Amorpha fruticosa . Фитохимия 1981 , 20 , 781–785. [ Академия Google ] [ CrossRef ]
- Крпан, АП; Томашич, Ж.; Башич Палкович, П. Биопотенциал индигобуша ( Amorpha fruticosa L.) – второй год исследования. Список Шумарского. 2011 , 135 , 103–112. [ Академика Google ]
- Кожухарова Е.; Матковский, А.; Возняк, Д.; Симеонова Р.; Найчов З.; Малайнер, К.; Мокан, А.; Набави, С.М.; Атанасов А.Г. Amorpha fruticosa – вредоносное инвазионное чужеродное растение в Европе или лекарственное растение от болезней обмена веществ? Передний. Фармакол. 2017 , 8 , 333. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Сигетвари, К. Первые шаги по восстановлению пойменного луга после десятилетия доминирования инвазивного кустарника-трансформера Amorpha fruticosa L. Tiscia 2002 , 33 , 67–77. [ Академика Google ]
- Педашенко, Л.П.; Апостолова, И.И.; Васильев К.В. Невселенность Amorpha fruticosa в различных местообитаниях нижнего Дуная. Фитол. Балк. 2012 , 18 , 285–291. [ Академика Google ]
- Ариануцу, М.; Базос, И.; Делипетру, П.; Коккорис, Ю. Инопланетная флора Греции: таксономия, особенности жизни и предпочтения среды обитания. Биол. Вторжения 2010 , 12 , 3525–3549. [ Академия Google ] [ CrossRef ]
- Самарас, АГ; Коутитас, К.Г. Моделирование воздействия на прибрежную морфологию управления водными ресурсами в трансграничных речных бассейнах: пример реки Нестос. Менеджер. Окружающая среда. Квал. Межд. Дж. 2008 , 19 , 455–466. [ Академия Google ] [ CrossRef ]
- Декамп, Х.; Декамп, О. Средиземноморские прибрежные леса ; Сохранение водно-болотных угодий Средиземноморья; Тур дю Валат: Арль, Франция, 2001 г. [ Google Scholar ]
- Маллинис, Г.; Эмманолудис, Д.; Яннакопулос, В.; Марис, Ф.; Куциас, Н. Картирование и интерпретация исторических изменений растительного покрова/землепользования на участке «Натура 2000» с использованием данных наблюдений за Землей: пример дельты Нестоса, Греция. Прил. геогр. 2011 , 31 , 312–320. [ Академия Google ] [ CrossRef ]
- Дафис, С.; Папастергиаду, Э.; Георгиу, К.; Бабалонас, Д.; Георгиадис, Т.; Папагеоргиу, М.; Лазариду, Т.; Циаусси, В. Греческий проект «среды обитания» Natura 2000: Обзор. Пожизненный контракт B4-32000/94/756 ; Комиссия Европейских Сообществ, Музей естественной истории Гуландриса, Центр греческих биотопов и водно-болотных угодий; Springer: Берлин/Гейдельберг, Германия, 1996. [ Google Scholar ]
- Бьянки, Л.; Пачи, М. Эволюционная динамика и тосканское обучение: Sintesi di quarant'anni di richerche. Для.-Ж. Сильвик. Для. Экол. 2008 , 5 , 122. [ Google Scholar ] [ CrossRef ]
- Векеманс, X.; Боуэнс, Т.; Лемэр, М.; Ролдан-Руис, И. Данные маркеров амплифицированного полиморфизма длин фрагментов (AFLP) указывают на гомоплазию по размеру и взаимосвязь между степенью гомоплазии и размером фрагмента. Мол. Экол. 2002 , 11 , 139–151. [ Академия Google ] [ CrossRef ]
- Пикалл, РОД; Смаус, ЧП Genalex 6: Генетический анализ в Excel. Программное обеспечение популяционной генетики для обучения и исследований. Мол. Экол. Примечания 2006 , 6 , 288–295. [ Академия Google ] [ CrossRef ]
- Тафтсоглу, М.; Валканиотис, С.; Папатанасиу, Г.; Климис, Н.; Докас, И. Подробная карта подверженности разжижению дельты реки Нестос, Фракия, Греция, основанная на поверхностной геологии и геоморфологии. Geosciences 2022 , 12 , 361. [ Академия Google ] [ CrossRef ]
- ДеХаан, Л.; Эльке, Н.; Шиффер, К.; Вайз, Д.; ДеХаан, Р. Оценка разнообразия североамериканских образцов ложного индиго ( Amorpha fruticosa L.) для корма и биомассы. Жене. Ресурс. Кроп Эвол. 2006 , 53 , 1463–1476. [ Академия Google ] [ CrossRef ]
- Ли, М.; Лю, З.; Лю, К.; Чжу, Ф.; Ван, К.; Ван, З.; Ли, Х.; Лан, X.; Гуан, К. Засухоустойчивость табака, сверхэкспрессирующего ген afnac1 Amorpha fruticosa Linn. Передний. Наука о растениях. 2022 , 13 , 980171. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Дат, Северная Каролина; Ли, Дж.-Х.; Лук-порей.; Хонг, Ю.-С.; Ким, Ю.Х.; Ли, Дж. Дж. Фенольные компоненты Amorpha fruticosa , которые ингибируют активацию nf-κb и связанную с ней экспрессию генов. Дж. Нэт. Прод. 2008 , 71 , 1696–1700. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Песня, Ф.; Ци, Д.; Лю, X.; Конг, X.; Гао, Ю.; Чжоу, З.; Ву, К. Протеомный анализ симбиотических белков Glomus mosseae и Amorpha fruticosa . наук. Rep. 2015 , 5 , 18031. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Тодорова Т.; Бояджиев, К.; Шкондров А.; Пырванова П.; Димитрова, М.; Ионкова И.; Крастева И.; Кожухарова Е.; Чанкова, С. Скрининг экстрактов Amorpha fruticosa и Ailanthus altissima на генотоксичность/антигенотоксичность, мутагенность/антимутагенность и канцерогенность/антиканцерогенность. БиоРиск 2022 , 17 , 201–212. [ Академия Google ] [ CrossRef ]
- Цветкович, Д.М.; Йованкич, СП; Милутинович, М.Г.; Никодиевич, Д.Д.; Грбович, Ф.Дж.; Чирич, АР; Топузович, доктор медицинских наук; Маркович, С.Д. Противоинвазивная активность Robinia pseudoacacia L. и Amorpha fruticosa L. На клеточной линии рака молочной железы mda-mb-231. Биология 2019 , 74 , 915–928. [ Академия Google ] [ CrossRef ]
2. Материалы и методы
2.1. Растительный материал
2.2. Процедура ПФЛП
2.3. Индекс регенерации

2.4. Сбор данных и статистический анализ данных AFLP
2.5. Информация о среде обитания 91E0*
3. Результаты
3.1. Генетические результаты



3.2. Плотность и индекс регенерации

4. Дискуссия
5. Выводы
Вклад автора
Финансирование
Заявление о доступности данных
Конфликт интересов
Рекомендации
- Ричардсон, DM; Пышек, П.; Рейманек, М.; Барбур, Миннесота; Панетта, Флорида; Уэст, К.Дж. Натурализация и вторжение чужеродных растений: концепции и определения. Дайверы. Распредел. 2000 , 6 , 93–107. [ Академия Google ] [ CrossRef ]
- Коракаки, Э.; Легакис, А.; Кацаневакис, С.; Кулелис, П.; Аврамиду, Э.; Сулиоти, Н.; Петракис, П. Инвазивные чужеродные виды Греции. Обсервация инвазивных чужеродных видов. Проблемы вокруг света 2021 , 3 , 124–189. [ Академика Google ]
- Мияваки, С.; Вашитани, И. Инвазивные чужеродные виды растений в прибрежных районах Японии: вклад сельскохозяйственных сорняков, видов восстановления растительности и аквакультурных видов. Глоб. Окружающая среда. Рез.-англ. Эд. 2004 , 8 , 89–101. [ Академика Google ]
- Каллауэй, РМ; Ашехуг, Э.Т. Инвазивные растения против их новых и старых соседей: механизм экзотического вторжения. Наука 2000 , 290 , 521–523. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Иванеску, Б.; Лунгу, К.; Власе, Л.; Градинару, AC; Тухилус, К. ВЭЖХ-анализ фенольных соединений, антиоксидантной и противомикробной активности Amorpha fruticosa L. Экстракты. Дж. Плант Дев. 2019 , 26 , 77. [ Академия Google ] [ CrossRef ]
- Штрауб, Южная Каролина; Извините, бакалавр; Уикли, А.С. Amorpha confusa , новое название старой Amorpha (Fabaceae: Amorpheae). Дж. Бот. Рез. Инст. Техас, 2009 г. , 151–155. [ Академика Google ]
- Штрауб, Южная Каролина; Дойл, Дж. Дж. Молекулярная филогенетика Amorpha (Fabaceae): оценка монофилии, видовых отношений и полиплоидного происхождения. Мол. Филогенетика Эвол. 2014 , 76 , 49–66. [ Академия Google ] [ CrossRef ]
- Лю, Дж.; Ван, ET; Chen, WX Разнообразные ризобии, связанные с древесными бобовыми культурами Wisteria sinensis , Cercis Racemosa и Amorpha fruticosa, выращиваемыми в умеренной зоне Китая. Сист. Прил. Микробиол. 2005 , 28 , 465–477. [ Академия Google ] [ CrossRef ]
- Китайский, П. Словарь китайской Materia Medica ; Китайская научно-техническая медицинская пресса: Пекин, Китай, 1997. [ Google Scholar ]
- Митчер, Луизиана; Парк, Ю.Х.; Альшамма, А.; Хадсон, ПБ; Хаас, Т. Аморфрутин a и b, бибензиловые противомикробные средства из Amorpha fruticosa . Фитохимия 1981 , 20 , 781–785. [ Академия Google ] [ CrossRef ]
- Крпан, АП; Томашич, Ж.; Башич Палкович, П. Биопотенциал индигобуша ( Amorpha fruticosa L.) – второй год исследования. Список Шумарского. 2011 , 135 , 103–112. [ Академика Google ]
- Кожухарова Е.; Матковский, А.; Возняк, Д.; Симеонова Р.; Найчов З.; Малайнер, К.; Мокан, А.; Набави, С.М.; Атанасов А.Г. Amorpha fruticosa – вредоносное инвазионное чужеродное растение в Европе или лекарственное растение от болезней обмена веществ? Передний. Фармакол. 2017 , 8 , 333. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Сигетвари, К. Первые шаги по восстановлению пойменного луга после десятилетия доминирования инвазивного кустарника-трансформера Amorpha fruticosa L. Tiscia 2002 , 33 , 67–77. [ Академика Google ]
- Педашенко, Л.П.; Апостолова, И.И.; Васильев К.В. Невселенность Amorpha fruticosa в различных местообитаниях нижнего Дуная. Фитол. Балк. 2012 , 18 , 285–291. [ Академика Google ]
- Ариануцу, М.; Базос, И.; Делипетру, П.; Коккорис, Ю. Инопланетная флора Греции: таксономия, особенности жизни и предпочтения среды обитания. Биол. Вторжения 2010 , 12 , 3525–3549. [ Академия Google ] [ CrossRef ]
- Самарас, АГ; Коутитас, К.Г. Моделирование воздействия на прибрежную морфологию управления водными ресурсами в трансграничных речных бассейнах: пример реки Нестос. Менеджер. Окружающая среда. Квал. Межд. Дж. 2008 , 19 , 455–466. [ Академия Google ] [ CrossRef ]
- Декамп, Х.; Декамп, О. Средиземноморские прибрежные леса ; Сохранение водно-болотных угодий Средиземноморья; Тур дю Валат: Арль, Франция, 2001 г. [ Google Scholar ]
- Маллинис, Г.; Эмманолудис, Д.; Яннакопулос, В.; Марис, Ф.; Куциас, Н. Картирование и интерпретация исторических изменений растительного покрова/землепользования на участке «Натура 2000» с использованием данных наблюдений за Землей: пример дельты Нестоса, Греция. Прил. геогр. 2011 , 31 , 312–320. [ Академия Google ] [ CrossRef ]
- Дафис, С.; Папастергиаду, Э.; Георгиу, К.; Бабалонас, Д.; Георгиадис, Т.; Папагеоргиу, М.; Лазариду, Т.; Циаусси, В. Греческий проект «среды обитания» Natura 2000: Обзор. Пожизненный контракт B4-32000/94/756 ; Комиссия Европейских Сообществ, Музей естественной истории Гуландриса, Центр греческих биотопов и водно-болотных угодий; Springer: Берлин/Гейдельберг, Германия, 1996. [ Google Scholar ]
- Бьянки, Л.; Пачи, М. Эволюционная динамика и тосканское обучение: Sintesi di quarant'anni di richerche. Для.-Ж. Сильвик. Для. Экол. 2008 , 5 , 122. [ Google Scholar ] [ CrossRef ]
- Векеманс, X.; Боуэнс, Т.; Лемэр, М.; Ролдан-Руис, И. Данные маркеров амплифицированного полиморфизма длин фрагментов (AFLP) указывают на гомоплазию по размеру и взаимосвязь между степенью гомоплазии и размером фрагмента. Мол. Экол. 2002 , 11 , 139–151. [ Академия Google ] [ CrossRef ]
- Пикалл, РОД; Смаус, ЧП Genalex 6: Генетический анализ в Excel. Программное обеспечение популяционной генетики для обучения и исследований. Мол. Экол. Примечания 2006 , 6 , 288–295. [ Академия Google ] [ CrossRef ]
- Тафтсоглу, М.; Валканиотис, С.; Папатанасиу, Г.; Климис, Н.; Докас, И. Подробная карта подверженности разжижению дельты реки Нестос, Фракия, Греция, основанная на поверхностной геологии и геоморфологии. Geosciences 2022 , 12 , 361. [ Академия Google ] [ CrossRef ]
- ДеХаан, Л.; Эльке, Н.; Шиффер, К.; Вайз, Д.; ДеХаан, Р. Оценка разнообразия североамериканских образцов ложного индиго ( Amorpha fruticosa L.) для корма и биомассы. Жене. Ресурс. Кроп Эвол. 2006 , 53 , 1463–1476. [ Академия Google ] [ CrossRef ]
- Ли, М.; Лю, З.; Лю, К.; Чжу, Ф.; Ван, К.; Ван, З.; Ли, Х.; Лан, X.; Гуан, К. Засухоустойчивость табака, сверхэкспрессирующего ген afnac1 Amorpha fruticosa Linn. Передний. Наука о растениях. 2022 , 13 , 980171. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Дат, Северная Каролина; Ли, Дж.-Х.; Лук-порей.; Хонг, Ю.-С.; Ким, Ю.Х.; Ли, Дж. Дж. Фенольные компоненты Amorpha fruticosa , которые ингибируют активацию nf-κb и связанную с ней экспрессию генов. Дж. Нэт. Прод. 2008 , 71 , 1696–1700. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Песня, Ф.; Ци, Д.; Лю, X.; Конг, X.; Гао, Ю.; Чжоу, З.; Ву, К. Протеомный анализ симбиотических белков Glomus mosseae и Amorpha fruticosa . наук. Rep. 2015 , 5 , 18031. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Тодорова Т.; Бояджиев, К.; Шкондров А.; Пырванова П.; Димитрова, М.; Ионкова И.; Крастева И.; Кожухарова Е.; Чанкова, С. Скрининг экстрактов Amorpha fruticosa и Ailanthus altissima на генотоксичность/антигенотоксичность, мутагенность/антимутагенность и канцерогенность/антиканцерогенность. БиоРиск 2022 , 17 , 201–212. [ Академия Google ] [ CrossRef ]
- Цветкович, Д.М.; Йованкич, СП; Милутинович, М.Г.; Никодиевич, Д.Д.; Грбович, Ф.Дж.; Чирич, АР; Топузович, доктор медицинских наук; Маркович, С.Д. Противоинвазивная активность Robinia pseudoacacia L. и Amorpha fruticosa L. На клеточной линии рака молочной железы mda-mb-231. Биология 2019 , 74 , 915–928. [ Академия Google ] [ CrossRef ]
2. Материалы и методы
2.1. Растительный материал
2.2. Процедура ПФЛП
2.3. Индекс регенерации

2.4. Сбор данных и статистический анализ данных AFLP
2.5. Информация о среде обитания 91E0*
3. Результаты
3.1. Генетические результаты



3.2. Плотность и индекс регенерации

4. Дискуссия
5. Выводы
Вклад автора
Финансирование
Заявление о доступности данных
Конфликт интересов
Рекомендации
- Ричардсон, DM; Пышек, П.; Рейманек, М.; Барбур, Миннесота; Панетта, Флорида; Уэст, К.Дж. Натурализация и вторжение чужеродных растений: концепции и определения. Дайверы. Распредел. 2000 , 6 , 93–107. [ Академия Google ] [ CrossRef ]
- Коракаки, Э.; Легакис, А.; Кацаневакис, С.; Кулелис, П.; Аврамиду, Э.; Сулиоти, Н.; Петракис, П. Инвазивные чужеродные виды Греции. Обсервация инвазивных чужеродных видов. Проблемы вокруг света 2021 , 3 , 124–189. [ Академика Google ]
- Мияваки, С.; Вашитани, И. Инвазивные чужеродные виды растений в прибрежных районах Японии: вклад сельскохозяйственных сорняков, видов восстановления растительности и аквакультурных видов. Глоб. Окружающая среда. Рез.-англ. Эд. 2004 , 8 , 89–101. [ Академика Google ]
- Каллауэй, РМ; Ашехуг, Э.Т. Инвазивные растения против их новых и старых соседей: механизм экзотического вторжения. Наука 2000 , 290 , 521–523. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Иванеску, Б.; Лунгу, К.; Власе, Л.; Градинару, AC; Тухилус, К. ВЭЖХ-анализ фенольных соединений, антиоксидантной и противомикробной активности Amorpha fruticosa L. Экстракты. Дж. Плант Дев. 2019 , 26 , 77. [ Академия Google ] [ CrossRef ]
- Штрауб, Южная Каролина; Извините, бакалавр; Уикли, А.С. Amorpha confusa , новое название старой Amorpha (Fabaceae: Amorpheae). Дж. Бот. Рез. Инст. Техас, 2009 г. , 151–155. [ Академика Google ]
- Штрауб, Южная Каролина; Дойл, Дж. Дж. Молекулярная филогенетика Amorpha (Fabaceae): оценка монофилии, видовых отношений и полиплоидного происхождения. Мол. Филогенетика Эвол. 2014 , 76 , 49–66. [ Академия Google ] [ CrossRef ]
- Лю, Дж.; Ван, ET; Chen, WX Разнообразные ризобии, связанные с древесными бобовыми культурами Wisteria sinensis , Cercis Racemosa и Amorpha fruticosa, выращиваемыми в умеренной зоне Китая. Сист. Прил. Микробиол. 2005 , 28 , 465–477. [ Академия Google ] [ CrossRef ]
- Китайский, П. Словарь китайской Materia Medica ; Китайская научно-техническая медицинская пресса: Пекин, Китай, 1997. [ Google Scholar ]
- Митчер, Луизиана; Парк, Ю.Х.; Альшамма, А.; Хадсон, ПБ; Хаас, Т. Аморфрутин a и b, бибензиловые противомикробные средства из Amorpha fruticosa . Фитохимия 1981 , 20 , 781–785. [ Академия Google ] [ CrossRef ]
- Крпан, АП; Томашич, Ж.; Башич Палкович, П. Биопотенциал индигобуша ( Amorpha fruticosa L.) – второй год исследования. Список Шумарского. 2011 , 135 , 103–112. [ Академика Google ]
- Кожухарова Е.; Матковский, А.; Возняк, Д.; Симеонова Р.; Найчов З.; Малайнер, К.; Мокан, А.; Набави, С.М.; Атанасов А.Г. Amorpha fruticosa – вредоносное инвазионное чужеродное растение в Европе или лекарственное растение от болезней обмена веществ? Передний. Фармакол. 2017 , 8 , 333. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Сигетвари, К. Первые шаги по восстановлению пойменного луга после десятилетия доминирования инвазивного кустарника-трансформера Amorpha fruticosa L. Tiscia 2002 , 33 , 67–77. [ Академика Google ]
- Педашенко, Л.П.; Апостолова, И.И.; Васильев К.В. Невселенность Amorpha fruticosa в различных местообитаниях нижнего Дуная. Фитол. Балк. 2012 , 18 , 285–291. [ Академика Google ]
- Ариануцу, М.; Базос, И.; Делипетру, П.; Коккорис, Ю. Инопланетная флора Греции: таксономия, особенности жизни и предпочтения среды обитания. Биол. Вторжения 2010 , 12 , 3525–3549. [ Академия Google ] [ CrossRef ]
- Самарас, АГ; Коутитас, К.Г. Моделирование воздействия на прибрежную морфологию управления водными ресурсами в трансграничных речных бассейнах: пример реки Нестос. Менеджер. Окружающая среда. Квал. Межд. Дж. 2008 , 19 , 455–466. [ Академия Google ] [ CrossRef ]
- Декамп, Х.; Декамп, О. Средиземноморские прибрежные леса ; Сохранение водно-болотных угодий Средиземноморья; Тур дю Валат: Арль, Франция, 2001 г. [ Google Scholar ]
- Маллинис, Г.; Эмманолудис, Д.; Яннакопулос, В.; Марис, Ф.; Куциас, Н. Картирование и интерпретация исторических изменений растительного покрова/землепользования на участке «Натура 2000» с использованием данных наблюдений за Землей: пример дельты Нестоса, Греция. Прил. геогр. 2011 , 31 , 312–320. [ Академия Google ] [ CrossRef ]
- Дафис, С.; Папастергиаду, Э.; Георгиу, К.; Бабалонас, Д.; Георгиадис, Т.; Папагеоргиу, М.; Лазариду, Т.; Циаусси, В. Греческий проект «среды обитания» Natura 2000: Обзор. Пожизненный контракт B4-32000/94/756 ; Комиссия Европейских Сообществ, Музей естественной истории Гуландриса, Центр греческих биотопов и водно-болотных угодий; Springer: Берлин/Гейдельберг, Германия, 1996. [ Google Scholar ]
- Бьянки, Л.; Пачи, М. Эволюционная динамика и тосканское обучение: Sintesi di quarant'anni di richerche. Для.-Ж. Сильвик. Для. Экол. 2008 , 5 , 122. [ Google Scholar ] [ CrossRef ]
- Векеманс, X.; Боуэнс, Т.; Лемэр, М.; Ролдан-Руис, И. Данные маркеров амплифицированного полиморфизма длин фрагментов (AFLP) указывают на гомоплазию по размеру и взаимосвязь между степенью гомоплазии и размером фрагмента. Мол. Экол. 2002 , 11 , 139–151. [ Академия Google ] [ CrossRef ]
- Пикалл, РОД; Смаус, ЧП Genalex 6: Генетический анализ в Excel. Программное обеспечение популяционной генетики для обучения и исследований. Мол. Экол. Примечания 2006 , 6 , 288–295. [ Академия Google ] [ CrossRef ]
- Тафтсоглу, М.; Валканиотис, С.; Папатанасиу, Г.; Климис, Н.; Докас, И. Подробная карта подверженности разжижению дельты реки Нестос, Фракия, Греция, основанная на поверхностной геологии и геоморфологии. Geosciences 2022 , 12 , 361. [ Академия Google ] [ CrossRef ]
- ДеХаан, Л.; Эльке, Н.; Шиффер, К.; Вайз, Д.; ДеХаан, Р. Оценка разнообразия североамериканских образцов ложного индиго ( Amorpha fruticosa L.) для корма и биомассы. Жене. Ресурс. Кроп Эвол. 2006 , 53 , 1463–1476. [ Академия Google ] [ CrossRef ]
- Ли, М.; Лю, З.; Лю, К.; Чжу, Ф.; Ван, К.; Ван, З.; Ли, Х.; Лан, X.; Гуан, К. Засухоустойчивость табака, сверхэкспрессирующего ген afnac1 Amorpha fruticosa Linn. Передний. Наука о растениях. 2022 , 13 , 980171. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Дат, Северная Каролина; Ли, Дж.-Х.; Лук-порей.; Хонг, Ю.-С.; Ким, Ю.Х.; Ли, Дж. Дж. Фенольные компоненты Amorpha fruticosa , которые ингибируют активацию nf-κb и связанную с ней экспрессию генов. Дж. Нэт. Прод. 2008 , 71 , 1696–1700. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Песня, Ф.; Ци, Д.; Лю, X.; Конг, X.; Гао, Ю.; Чжоу, З.; Ву, К. Протеомный анализ симбиотических белков Glomus mosseae и Amorpha fruticosa . наук. Rep. 2015 , 5 , 18031. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Тодорова Т.; Бояджиев, К.; Шкондров А.; Пырванова П.; Димитрова, М.; Ионкова И.; Крастева И.; Кожухарова Е.; Чанкова, С. Скрининг экстрактов Amorpha fruticosa и Ailanthus altissima на генотоксичность/антигенотоксичность, мутагенность/антимутагенность и канцерогенность/антиканцерогенность. БиоРиск 2022 , 17 , 201–212. [ Академия Google ] [ CrossRef ]
- Цветкович, Д.М.; Йованкич, СП; Милутинович, М.Г.; Никодиевич, Д.Д.; Грбович, Ф.Дж.; Чирич, АР; Топузович, доктор медицинских наук; Маркович, С.Д. Противоинвазивная активность Robinia pseudoacacia L. и Amorpha fruticosa L. На клеточной линии рака молочной железы mda-mb-231. Биология 2019 , 74 , 915–928. [ Академия Google ] [ CrossRef ]
2. Материалы и методы
2.1. Растительный материал
2.2. Процедура ПФЛП
2.3. Индекс регенерации

2.4. Сбор данных и статистический анализ данных AFLP
2.5. Информация о среде обитания 91E0*
3. Результаты
3.1. Генетические результаты



3.2. Плотность и индекс регенерации

4. Дискуссия
5. Выводы
Вклад автора
Финансирование
Заявление о доступности данных
Конфликт интересов
Рекомендации
- Ричардсон, DM; Пышек, П.; Рейманек, М.; Барбур, Миннесота; Панетта, Флорида; Уэст, К.Дж. Натурализация и вторжение чужеродных растений: концепции и определения. Дайверы. Распредел. 2000 , 6 , 93–107. [ Академия Google ] [ CrossRef ]
- Коракаки, Э.; Легакис, А.; Кацаневакис, С.; Кулелис, П.; Аврамиду, Э.; Сулиоти, Н.; Петракис, П. Инвазивные чужеродные виды Греции. Обсервация инвазивных чужеродных видов. Проблемы вокруг света 2021 , 3 , 124–189. [ Академика Google ]
- Мияваки, С.; Вашитани, И. Инвазивные чужеродные виды растений в прибрежных районах Японии: вклад сельскохозяйственных сорняков, видов восстановления растительности и аквакультурных видов. Глоб. Окружающая среда. Рез.-англ. Эд. 2004 , 8 , 89–101. [ Академика Google ]
- Каллауэй, РМ; Ашехуг, Э.Т. Инвазивные растения против их новых и старых соседей: механизм экзотического вторжения. Наука 2000 , 290 , 521–523. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Иванеску, Б.; Лунгу, К.; Власе, Л.; Градинару, AC; Тухилус, К. ВЭЖХ-анализ фенольных соединений, антиоксидантной и противомикробной активности Amorpha fruticosa L. Экстракты. Дж. Плант Дев. 2019 , 26 , 77. [ Академия Google ] [ CrossRef ]
- Штрауб, Южная Каролина; Извините, бакалавр; Уикли, А.С. Amorpha confusa , новое название старой Amorpha (Fabaceae: Amorpheae). Дж. Бот. Рез. Инст. Техас, 2009 г. , 151–155. [ Академика Google ]
- Штрауб, Южная Каролина; Дойл, Дж. Дж. Молекулярная филогенетика Amorpha (Fabaceae): оценка монофилии, видовых отношений и полиплоидного происхождения. Мол. Филогенетика Эвол. 2014 , 76 , 49–66. [ Академия Google ] [ CrossRef ]
- Лю, Дж.; Ван, ET; Chen, WX Разнообразные ризобии, связанные с древесными бобовыми культурами Wisteria sinensis , Cercis Racemosa и Amorpha fruticosa, выращиваемыми в умеренной зоне Китая. Сист. Прил. Микробиол. 2005 , 28 , 465–477. [ Академия Google ] [ CrossRef ]
- Китайский, П. Словарь китайской Materia Medica ; Китайская научно-техническая медицинская пресса: Пекин, Китай, 1997. [ Google Scholar ]
- Митчер, Луизиана; Парк, Ю.Х.; Альшамма, А.; Хадсон, ПБ; Хаас, Т. Аморфрутин a и b, бибензиловые противомикробные средства из Amorpha fruticosa . Фитохимия 1981 , 20 , 781–785. [ Академия Google ] [ CrossRef ]
- Крпан, АП; Томашич, Ж.; Башич Палкович, П. Биопотенциал индигобуша ( Amorpha fruticosa L.) – второй год исследования. Список Шумарского. 2011 , 135 , 103–112. [ Академика Google ]
- Кожухарова Е.; Матковский, А.; Возняк, Д.; Симеонова Р.; Найчов З.; Малайнер, К.; Мокан, А.; Набави, С.М.; Атанасов А.Г. Amorpha fruticosa – вредоносное инвазионное чужеродное растение в Европе или лекарственное растение от болезней обмена веществ? Передний. Фармакол. 2017 , 8 , 333. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Сигетвари, К. Первые шаги по восстановлению пойменного луга после десятилетия доминирования инвазивного кустарника-трансформера Amorpha fruticosa L. Tiscia 2002 , 33 , 67–77. [ Академика Google ]
- Педашенко, Л.П.; Апостолова, И.И.; Васильев К.В. Невселенность Amorpha fruticosa в различных местообитаниях нижнего Дуная. Фитол. Балк. 2012 , 18 , 285–291. [ Академика Google ]
- Ариануцу, М.; Базос, И.; Делипетру, П.; Коккорис, Ю. Инопланетная флора Греции: таксономия, особенности жизни и предпочтения среды обитания. Биол. Вторжения 2010 , 12 , 3525–3549. [ Академия Google ] [ CrossRef ]
- Самарас, АГ; Коутитас, К.Г. Моделирование воздействия на прибрежную морфологию управления водными ресурсами в трансграничных речных бассейнах: пример реки Нестос. Менеджер. Окружающая среда. Квал. Межд. Дж. 2008 , 19 , 455–466. [ Академия Google ] [ CrossRef ]
- Декамп, Х.; Декамп, О. Средиземноморские прибрежные леса ; Сохранение водно-болотных угодий Средиземноморья; Тур дю Валат: Арль, Франция, 2001 г. [ Google Scholar ]
- Маллинис, Г.; Эмманолудис, Д.; Яннакопулос, В.; Марис, Ф.; Куциас, Н. Картирование и интерпретация исторических изменений растительного покрова/землепользования на участке «Натура 2000» с использованием данных наблюдений за Землей: пример дельты Нестоса, Греция. Прил. геогр. 2011 , 31 , 312–320. [ Академия Google ] [ CrossRef ]
- Дафис, С.; Папастергиаду, Э.; Георгиу, К.; Бабалонас, Д.; Георгиадис, Т.; Папагеоргиу, М.; Лазариду, Т.; Циаусси, В. Греческий проект «среды обитания» Natura 2000: Обзор. Пожизненный контракт B4-32000/94/756 ; Комиссия Европейских Сообществ, Музей естественной истории Гуландриса, Центр греческих биотопов и водно-болотных угодий; Springer: Берлин/Гейдельберг, Германия, 1996. [ Google Scholar ]
- Бьянки, Л.; Пачи, М. Эволюционная динамика и тосканское обучение: Sintesi di quarant'anni di richerche. Для.-Ж. Сильвик. Для. Экол. 2008 , 5 , 122. [ Google Scholar ] [ CrossRef ]
- Векеманс, X.; Боуэнс, Т.; Лемэр, М.; Ролдан-Руис, И. Данные маркеров амплифицированного полиморфизма длин фрагментов (AFLP) указывают на гомоплазию по размеру и взаимосвязь между степенью гомоплазии и размером фрагмента. Мол. Экол. 2002 , 11 , 139–151. [ Академия Google ] [ CrossRef ]
- Пикалл, РОД; Смаус, ЧП Genalex 6: Генетический анализ в Excel. Программное обеспечение популяционной генетики для обучения и исследований. Мол. Экол. Примечания 2006 , 6 , 288–295. [ Академия Google ] [ CrossRef ]
- Тафтсоглу, М.; Валканиотис, С.; Папатанасиу, Г.; Климис, Н.; Докас, И. Подробная карта подверженности разжижению дельты реки Нестос, Фракия, Греция, основанная на поверхностной геологии и геоморфологии. Geosciences 2022 , 12 , 361. [ Академия Google ] [ CrossRef ]
- ДеХаан, Л.; Эльке, Н.; Шиффер, К.; Вайз, Д.; ДеХаан, Р. Оценка разнообразия североамериканских образцов ложного индиго ( Amorpha fruticosa L.) для корма и биомассы. Жене. Ресурс. Кроп Эвол. 2006 , 53 , 1463–1476. [ Академия Google ] [ CrossRef ]
- Ли, М.; Лю, З.; Лю, К.; Чжу, Ф.; Ван, К.; Ван, З.; Ли, Х.; Лан, X.; Гуан, К. Засухоустойчивость табака, сверхэкспрессирующего ген afnac1 Amorpha fruticosa Linn. Передний. Наука о растениях. 2022 , 13 , 980171. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Дат, Северная Каролина; Ли, Дж.-Х.; Лук-порей.; Хонг, Ю.-С.; Ким, Ю.Х.; Ли, Дж. Дж. Фенольные компоненты Amorpha fruticosa , которые ингибируют активацию nf-κb и связанную с ней экспрессию генов. Дж. Нэт. Прод. 2008 , 71 , 1696–1700. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Песня, Ф.; Ци, Д.; Лю, X.; Конг, X.; Гао, Ю.; Чжоу, З.; Ву, К. Протеомный анализ симбиотических белков Glomus mosseae и Amorpha fruticosa . наук. Rep. 2015 , 5 , 18031. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Тодорова Т.; Бояджиев, К.; Шкондров А.; Пырванова П.; Димитрова, М.; Ионкова И.; Крастева И.; Кожухарова Е.; Чанкова, С. Скрининг экстрактов Amorpha fruticosa и Ailanthus altissima на генотоксичность/антигенотоксичность, мутагенность/антимутагенность и канцерогенность/антиканцерогенность. БиоРиск 2022 , 17 , 201–212. [ Академия Google ] [ CrossRef ]
- Цветкович, Д.М.; Йованкич, СП; Милутинович, М.Г.; Никодиевич, Д.Д.; Грбович, Ф.Дж.; Чирич, АР; Топузович, доктор медицинских наук; Маркович, С.Д. Противоинвазивная активность Robinia pseudoacacia L. и Amorpha fruticosa L. На клеточной линии рака молочной железы mda-mb-231. Биология 2019 , 74 , 915–928. [ Академия Google ] [ CrossRef ]
2. Материалы и методы
2.1. Растительный материал
2.2. Процедура ПФЛП
2.3. Индекс регенерации

2.4. Сбор данных и статистический анализ данных AFLP
2.5. Информация о среде обитания 91E0*
3. Результаты
3.1. Генетические результаты



3.2. Плотность и индекс регенерации

4. Дискуссия
5. Выводы
Вклад автора
Финансирование
Заявление о доступности данных
Конфликт интересов
Рекомендации
- Ричардсон, DM; Пышек, П.; Рейманек, М.; Барбур, Миннесота; Панетта, Флорида; Уэст, К.Дж. Натурализация и вторжение чужеродных растений: концепции и определения. Дайверы. Распредел. 2000 , 6 , 93–107. [ Академия Google ] [ CrossRef ]
- Коракаки, Э.; Легакис, А.; Кацаневакис, С.; Кулелис, П.; Аврамиду, Э.; Сулиоти, Н.; Петракис, П. Инвазивные чужеродные виды Греции. Обсервация инвазивных чужеродных видов. Проблемы вокруг света 2021 , 3 , 124–189. [ Академика Google ]
- Мияваки, С.; Вашитани, И. Инвазивные чужеродные виды растений в прибрежных районах Японии: вклад сельскохозяйственных сорняков, видов восстановления растительности и аквакультурных видов. Глоб. Окружающая среда. Рез.-англ. Эд. 2004 , 8 , 89–101. [ Академика Google ]
- Каллауэй, РМ; Ашехуг, Э.Т. Инвазивные растения против их новых и старых соседей: механизм экзотического вторжения. Наука 2000 , 290 , 521–523. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Иванеску, Б.; Лунгу, К.; Власе, Л.; Градинару, AC; Тухилус, К. ВЭЖХ-анализ фенольных соединений, антиоксидантной и противомикробной активности Amorpha fruticosa L. Экстракты. Дж. Плант Дев. 2019 , 26 , 77. [ Академия Google ] [ CrossRef ]
- Штрауб, Южная Каролина; Извините, бакалавр; Уикли, А.С. Amorpha confusa , новое название старой Amorpha (Fabaceae: Amorpheae). Дж. Бот. Рез. Инст. Техас, 2009 г. , 151–155. [ Академика Google ]
- Штрауб, Южная Каролина; Дойл, Дж. Дж. Молекулярная филогенетика Amorpha (Fabaceae): оценка монофилии, видовых отношений и полиплоидного происхождения. Мол. Филогенетика Эвол. 2014 , 76 , 49–66. [ Академия Google ] [ CrossRef ]
- Лю, Дж.; Ван, ET; Chen, WX Разнообразные ризобии, связанные с древесными бобовыми культурами Wisteria sinensis , Cercis Racemosa и Amorpha fruticosa, выращиваемыми в умеренной зоне Китая. Сист. Прил. Микробиол. 2005 , 28 , 465–477. [ Академия Google ] [ CrossRef ]
- Китайский, П. Словарь китайской Materia Medica ; Китайская научно-техническая медицинская пресса: Пекин, Китай, 1997. [ Google Scholar ]
- Митчер, Луизиана; Парк, Ю.Х.; Альшамма, А.; Хадсон, ПБ; Хаас, Т. Аморфрутин a и b, бибензиловые противомикробные средства из Amorpha fruticosa . Фитохимия 1981 , 20 , 781–785. [ Академия Google ] [ CrossRef ]
- Крпан, АП; Томашич, Ж.; Башич Палкович, П. Биопотенциал индигобуша ( Amorpha fruticosa L.) – второй год исследования. Список Шумарского. 2011 , 135 , 103–112. [ Академика Google ]
- Кожухарова Е.; Матковский, А.; Возняк, Д.; Симеонова Р.; Найчов З.; Малайнер, К.; Мокан, А.; Набави, С.М.; Атанасов А.Г. Amorpha fruticosa – вредоносное инвазионное чужеродное растение в Европе или лекарственное растение от болезней обмена веществ? Передний. Фармакол. 2017 , 8 , 333. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Сигетвари, К. Первые шаги по восстановлению пойменного луга после десятилетия доминирования инвазивного кустарника-трансформера Amorpha fruticosa L. Tiscia 2002 , 33 , 67–77. [ Академика Google ]
- Педашенко, Л.П.; Апостолова, И.И.; Васильев К.В. Невселенность Amorpha fruticosa в различных местообитаниях нижнего Дуная. Фитол. Балк. 2012 , 18 , 285–291. [ Академика Google ]
- Ариануцу, М.; Базос, И.; Делипетру, П.; Коккорис, Ю. Инопланетная флора Греции: таксономия, особенности жизни и предпочтения среды обитания. Биол. Вторжения 2010 , 12 , 3525–3549. [ Академия Google ] [ CrossRef ]
- Самарас, АГ; Коутитас, К.Г. Моделирование воздействия на прибрежную морфологию управления водными ресурсами в трансграничных речных бассейнах: пример реки Нестос. Менеджер. Окружающая среда. Квал. Межд. Дж. 2008 , 19 , 455–466. [ Академия Google ] [ CrossRef ]
- Декамп, Х.; Декамп, О. Средиземноморские прибрежные леса ; Сохранение водно-болотных угодий Средиземноморья; Тур дю Валат: Арль, Франция, 2001 г. [ Google Scholar ]
- Маллинис, Г.; Эмманолудис, Д.; Яннакопулос, В.; Марис, Ф.; Куциас, Н. Картирование и интерпретация исторических изменений растительного покрова/землепользования на участке «Натура 2000» с использованием данных наблюдений за Землей: пример дельты Нестоса, Греция. Прил. геогр. 2011 , 31 , 312–320. [ Академия Google ] [ CrossRef ]
- Дафис, С.; Папастергиаду, Э.; Георгиу, К.; Бабалонас, Д.; Георгиадис, Т.; Папагеоргиу, М.; Лазариду, Т.; Циаусси, В. Греческий проект «среды обитания» Natura 2000: Обзор. Пожизненный контракт B4-32000/94/756 ; Комиссия Европейских Сообществ, Музей естественной истории Гуландриса, Центр греческих биотопов и водно-болотных угодий; Springer: Берлин/Гейдельберг, Германия, 1996. [ Google Scholar ]
- Бьянки, Л.; Пачи, М. Эволюционная динамика и тосканское обучение: Sintesi di quarant'anni di richerche. Для.-Ж. Сильвик. Для. Экол. 2008 , 5 , 122. [ Google Scholar ] [ CrossRef ]
- Векеманс, X.; Боуэнс, Т.; Лемэр, М.; Ролдан-Руис, И. Данные маркеров амплифицированного полиморфизма длин фрагментов (AFLP) указывают на гомоплазию по размеру и взаимосвязь между степенью гомоплазии и размером фрагмента. Мол. Экол. 2002 , 11 , 139–151. [ Академия Google ] [ CrossRef ]
- Пикалл, РОД; Смаус, ЧП Genalex 6: Генетический анализ в Excel. Программное обеспечение популяционной генетики для обучения и исследований. Мол. Экол. Примечания 2006 , 6 , 288–295. [ Академия Google ] [ CrossRef ]
- Тафтсоглу, М.; Валканиотис, С.; Папатанасиу, Г.; Климис, Н.; Докас, И. Подробная карта подверженности разжижению дельты реки Нестос, Фракия, Греция, основанная на поверхностной геологии и геоморфологии. Geosciences 2022 , 12 , 361. [ Академия Google ] [ CrossRef ]
- ДеХаан, Л.; Эльке, Н.; Шиффер, К.; Вайз, Д.; ДеХаан, Р. Оценка разнообразия североамериканских образцов ложного индиго ( Amorpha fruticosa L.) для корма и биомассы. Жене. Ресурс. Кроп Эвол. 2006 , 53 , 1463–1476. [ Академия Google ] [ CrossRef ]
- Ли, М.; Лю, З.; Лю, К.; Чжу, Ф.; Ван, К.; Ван, З.; Ли, Х.; Лан, X.; Гуан, К. Засухоустойчивость табака, сверхэкспрессирующего ген afnac1 Amorpha fruticosa Linn. Передний. Наука о растениях. 2022 , 13 , 980171. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Дат, Северная Каролина; Ли, Дж.-Х.; Лук-порей.; Хонг, Ю.-С.; Ким, Ю.Х.; Ли, Дж. Дж. Фенольные компоненты Amorpha fruticosa , которые ингибируют активацию nf-κb и связанную с ней экспрессию генов. Дж. Нэт. Прод. 2008 , 71 , 1696–1700. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Песня, Ф.; Ци, Д.; Лю, X.; Конг, X.; Гао, Ю.; Чжоу, З.; Ву, К. Протеомный анализ симбиотических белков Glomus mosseae и Amorpha fruticosa . наук. Rep. 2015 , 5 , 18031. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Тодорова Т.; Бояджиев, К.; Шкондров А.; Пырванова П.; Димитрова, М.; Ионкова И.; Крастева И.; Кожухарова Е.; Чанкова, С. Скрининг экстрактов Amorpha fruticosa и Ailanthus altissima на генотоксичность/антигенотоксичность, мутагенность/антимутагенность и канцерогенность/антиканцерогенность. БиоРиск 2022 , 17 , 201–212. [ Академия Google ] [ CrossRef ]
- Цветкович, Д.М.; Йованкич, СП; Милутинович, М.Г.; Никодиевич, Д.Д.; Грбович, Ф.Дж.; Чирич, АР; Топузович, доктор медицинских наук; Маркович, С.Д. Противоинвазивная активность Robinia pseudoacacia L. и Amorpha fruticosa L. На клеточной линии рака молочной железы mda-mb-231. Биология 2019 , 74 , 915–928. [ Академия Google ] [ CrossRef ]
2. Материалы и методы
2.1. Растительный материал
2.2. Процедура ПФЛП
2.3. Индекс регенерации

2.4. Сбор данных и статистический анализ данных AFLP
2.5. Информация о среде обитания 91E0*
3. Результаты
3.1. Генетические результаты



3.2. Плотность и индекс регенерации

4. Дискуссия
5. Выводы
Вклад автора
Финансирование
Заявление о доступности данных
Конфликт интересов
Рекомендации
- Ричардсон, DM; Пышек, П.; Рейманек, М.; Барбур, Миннесота; Панетта, Флорида; Уэст, К.Дж. Натурализация и вторжение чужеродных растений: концепции и определения. Дайверы. Распредел. 2000 , 6 , 93–107. [ Академия Google ] [ CrossRef ]
- Коракаки, Э.; Легакис, А.; Кацаневакис, С.; Кулелис, П.; Аврамиду, Э.; Сулиоти, Н.; Петракис, П. Инвазивные чужеродные виды Греции. Обсервация инвазивных чужеродных видов. Проблемы вокруг света 2021 , 3 , 124–189. [ Академика Google ]
- Мияваки, С.; Вашитани, И. Инвазивные чужеродные виды растений в прибрежных районах Японии: вклад сельскохозяйственных сорняков, видов восстановления растительности и аквакультурных видов. Глоб. Окружающая среда. Рез.-англ. Эд. 2004 , 8 , 89–101. [ Академика Google ]
- Каллауэй, РМ; Ашехуг, Э.Т. Инвазивные растения против их новых и старых соседей: механизм экзотического вторжения. Наука 2000 , 290 , 521–523. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Иванеску, Б.; Лунгу, К.; Власе, Л.; Градинару, AC; Тухилус, К. ВЭЖХ-анализ фенольных соединений, антиоксидантной и противомикробной активности Amorpha fruticosa L. Экстракты. Дж. Плант Дев. 2019 , 26 , 77. [ Академия Google ] [ CrossRef ]
- Штрауб, Южная Каролина; Извините, бакалавр; Уикли, А.С. Amorpha confusa , новое название старой Amorpha (Fabaceae: Amorpheae). Дж. Бот. Рез. Инст. Техас, 2009 г. , 151–155. [ Академика Google ]
- Штрауб, Южная Каролина; Дойл, Дж. Дж. Молекулярная филогенетика Amorpha (Fabaceae): оценка монофилии, видовых отношений и полиплоидного происхождения. Мол. Филогенетика Эвол. 2014 , 76 , 49–66. [ Академия Google ] [ CrossRef ]
- Лю, Дж.; Ван, ET; Chen, WX Разнообразные ризобии, связанные с древесными бобовыми культурами Wisteria sinensis , Cercis Racemosa и Amorpha fruticosa, выращиваемыми в умеренной зоне Китая. Сист. Прил. Микробиол. 2005 , 28 , 465–477. [ Академия Google ] [ CrossRef ]
- Китайский, П. Словарь китайской Materia Medica ; Китайская научно-техническая медицинская пресса: Пекин, Китай, 1997. [ Google Scholar ]
- Митчер, Луизиана; Парк, Ю.Х.; Альшамма, А.; Хадсон, ПБ; Хаас, Т. Аморфрутин a и b, бибензиловые противомикробные средства из Amorpha fruticosa . Фитохимия 1981 , 20 , 781–785. [ Академия Google ] [ CrossRef ]
- Крпан, АП; Томашич, Ж.; Башич Палкович, П. Биопотенциал индигобуша ( Amorpha fruticosa L.) – второй год исследования. Список Шумарского. 2011 , 135 , 103–112. [ Академика Google ]
- Кожухарова Е.; Матковский, А.; Возняк, Д.; Симеонова Р.; Найчов З.; Малайнер, К.; Мокан, А.; Набави, С.М.; Атанасов А.Г. Amorpha fruticosa – вредоносное инвазионное чужеродное растение в Европе или лекарственное растение от болезней обмена веществ? Передний. Фармакол. 2017 , 8 , 333. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Сигетвари, К. Первые шаги по восстановлению пойменного луга после десятилетия доминирования инвазивного кустарника-трансформера Amorpha fruticosa L. Tiscia 2002 , 33 , 67–77. [ Академика Google ]
- Педашенко, Л.П.; Апостолова, И.И.; Васильев К.В. Невселенность Amorpha fruticosa в различных местообитаниях нижнего Дуная. Фитол. Балк. 2012 , 18 , 285–291. [ Академика Google ]
- Ариануцу, М.; Базос, И.; Делипетру, П.; Коккорис, Ю. Инопланетная флора Греции: таксономия, особенности жизни и предпочтения среды обитания. Биол. Вторжения 2010 , 12 , 3525–3549. [ Академия Google ] [ CrossRef ]
- Самарас, АГ; Коутитас, К.Г. Моделирование воздействия на прибрежную морфологию управления водными ресурсами в трансграничных речных бассейнах: пример реки Нестос. Менеджер. Окружающая среда. Квал. Межд. Дж. 2008 , 19 , 455–466. [ Академия Google ] [ CrossRef ]
- Декамп, Х.; Декамп, О. Средиземноморские прибрежные леса ; Сохранение водно-болотных угодий Средиземноморья; Тур дю Валат: Арль, Франция, 2001 г. [ Google Scholar ]
- Маллинис, Г.; Эмманолудис, Д.; Яннакопулос, В.; Марис, Ф.; Куциас, Н. Картирование и интерпретация исторических изменений растительного покрова/землепользования на участке «Натура 2000» с использованием данных наблюдений за Землей: пример дельты Нестоса, Греция. Прил. геогр. 2011 , 31 , 312–320. [ Академия Google ] [ CrossRef ]
- Дафис, С.; Папастергиаду, Э.; Георгиу, К.; Бабалонас, Д.; Георгиадис, Т.; Папагеоргиу, М.; Лазариду, Т.; Циаусси, В. Греческий проект «среды обитания» Natura 2000: Обзор. Пожизненный контракт B4-32000/94/756 ; Комиссия Европейских Сообществ, Музей естественной истории Гуландриса, Центр греческих биотопов и водно-болотных угодий; Springer: Берлин/Гейдельберг, Германия, 1996. [ Google Scholar ]
- Бьянки, Л.; Пачи, М. Эволюционная динамика и тосканское обучение: Sintesi di quarant'anni di richerche. Для.-Ж. Сильвик. Для. Экол. 2008 , 5 , 122. [ Google Scholar ] [ CrossRef ]
- Векеманс, X.; Боуэнс, Т.; Лемэр, М.; Ролдан-Руис, И. Данные маркеров амплифицированного полиморфизма длин фрагментов (AFLP) указывают на гомоплазию по размеру и взаимосвязь между степенью гомоплазии и размером фрагмента. Мол. Экол. 2002 , 11 , 139–151. [ Академия Google ] [ CrossRef ]
- Пикалл, РОД; Смаус, ЧП Genalex 6: Генетический анализ в Excel. Программное обеспечение популяционной генетики для обучения и исследований. Мол. Экол. Примечания 2006 , 6 , 288–295. [ Академия Google ] [ CrossRef ]
- Тафтсоглу, М.; Валканиотис, С.; Папатанасиу, Г.; Климис, Н.; Докас, И. Подробная карта подверженности разжижению дельты реки Нестос, Фракия, Греция, основанная на поверхностной геологии и геоморфологии. Geosciences 2022 , 12 , 361. [ Академия Google ] [ CrossRef ]
- ДеХаан, Л.; Эльке, Н.; Шиффер, К.; Вайз, Д.; ДеХаан, Р. Оценка разнообразия североамериканских образцов ложного индиго ( Amorpha fruticosa L.) для корма и биомассы. Жене. Ресурс. Кроп Эвол. 2006 , 53 , 1463–1476. [ Академия Google ] [ CrossRef ]
- Ли, М.; Лю, З.; Лю, К.; Чжу, Ф.; Ван, К.; Ван, З.; Ли, Х.; Лан, X.; Гуан, К. Засухоустойчивость табака, сверхэкспрессирующего ген afnac1 Amorpha fruticosa Linn. Передний. Наука о растениях. 2022 , 13 , 980171. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Дат, Северная Каролина; Ли, Дж.-Х.; Лук-порей.; Хонг, Ю.-С.; Ким, Ю.Х.; Ли, Дж. Дж. Фенольные компоненты Amorpha fruticosa , которые ингибируют активацию nf-κb и связанную с ней экспрессию генов. Дж. Нэт. Прод. 2008 , 71 , 1696–1700. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Песня, Ф.; Ци, Д.; Лю, X.; Конг, X.; Гао, Ю.; Чжоу, З.; Ву, К. Протеомный анализ симбиотических белков Glomus mosseae и Amorpha fruticosa . наук. Rep. 2015 , 5 , 18031. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Тодорова Т.; Бояджиев, К.; Шкондров А.; Пырванова П.; Димитрова, М.; Ионкова И.; Крастева И.; Кожухарова Е.; Чанкова, С. Скрининг экстрактов Amorpha fruticosa и Ailanthus altissima на генотоксичность/антигенотоксичность, мутагенность/антимутагенность и канцерогенность/антиканцерогенность. БиоРиск 2022 , 17 , 201–212. [ Академия Google ] [ CrossRef ]
- Цветкович, Д.М.; Йованкич, СП; Милутинович, М.Г.; Никодиевич, Д.Д.; Грбович, Ф.Дж.; Чирич, АР; Топузович, доктор медицинских наук; Маркович, С.Д. Противоинвазивная активность Robinia pseudoacacia L. и Amorpha fruticosa L. На клеточной линии рака молочной железы mda-mb-231. Биология 2019 , 74 , 915–928. [ Академия Google ] [ CrossRef ]
2. Материалы и методы
2.1. Растительный материал
2.2. Процедура ПФЛП
2.3. Индекс регенерации

2.4. Сбор данных и статистический анализ данных AFLP
2.5. Информация о среде обитания 91E0*
3. Результаты
3.1. Генетические результаты



3.2. Плотность и индекс регенерации

4. Дискуссия
5. Выводы
Вклад автора
Финансирование
Заявление о доступности данных
Конфликт интересов
Рекомендации
- Ричардсон, DM; Пышек, П.; Рейманек, М.; Барбур, Миннесота; Панетта, Флорида; Уэст, К.Дж. Натурализация и вторжение чужеродных растений: концепции и определения. Дайверы. Распредел. 2000 , 6 , 93–107. [ Академия Google ] [ CrossRef ]
- Коракаки, Э.; Легакис, А.; Кацаневакис, С.; Кулелис, П.; Аврамиду, Э.; Сулиоти, Н.; Петракис, П. Инвазивные чужеродные виды Греции. Обсервация инвазивных чужеродных видов. Проблемы вокруг света 2021 , 3 , 124–189. [ Академика Google ]
- Мияваки, С.; Вашитани, И. Инвазивные чужеродные виды растений в прибрежных районах Японии: вклад сельскохозяйственных сорняков, видов восстановления растительности и аквакультурных видов. Глоб. Окружающая среда. Рез.-англ. Эд. 2004 , 8 , 89–101. [ Академика Google ]
- Каллауэй, РМ; Ашехуг, Э.Т. Инвазивные растения против их новых и старых соседей: механизм экзотического вторжения. Наука 2000 , 290 , 521–523. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Иванеску, Б.; Лунгу, К.; Власе, Л.; Градинару, AC; Тухилус, К. ВЭЖХ-анализ фенольных соединений, антиоксидантной и противомикробной активности Amorpha fruticosa L. Экстракты. Дж. Плант Дев. 2019 , 26 , 77. [ Академия Google ] [ CrossRef ]
- Штрауб, Южная Каролина; Извините, бакалавр; Уикли, А.С. Amorpha confusa , новое название старой Amorpha (Fabaceae: Amorpheae). Дж. Бот. Рез. Инст. Техас, 2009 г. , 151–155. [ Академика Google ]
- Штрауб, Южная Каролина; Дойл, Дж. Дж. Молекулярная филогенетика Amorpha (Fabaceae): оценка монофилии, видовых отношений и полиплоидного происхождения. Мол. Филогенетика Эвол. 2014 , 76 , 49–66. [ Академия Google ] [ CrossRef ]
- Лю, Дж.; Ван, ET; Chen, WX Разнообразные ризобии, связанные с древесными бобовыми культурами Wisteria sinensis , Cercis Racemosa и Amorpha fruticosa, выращиваемыми в умеренной зоне Китая. Сист. Прил. Микробиол. 2005 , 28 , 465–477. [ Академия Google ] [ CrossRef ]
- Китайский, П. Словарь китайской Materia Medica ; Китайская научно-техническая медицинская пресса: Пекин, Китай, 1997. [ Google Scholar ]
- Митчер, Луизиана; Парк, Ю.Х.; Альшамма, А.; Хадсон, ПБ; Хаас, Т. Аморфрутин a и b, бибензиловые противомикробные средства из Amorpha fruticosa . Фитохимия 1981 , 20 , 781–785. [ Академия Google ] [ CrossRef ]
- Крпан, АП; Томашич, Ж.; Башич Палкович, П. Биопотенциал индигобуша ( Amorpha fruticosa L.) – второй год исследования. Список Шумарского. 2011 , 135 , 103–112. [ Академика Google ]
- Кожухарова Е.; Матковский, А.; Возняк, Д.; Симеонова Р.; Найчов З.; Малайнер, К.; Мокан, А.; Набави, С.М.; Атанасов А.Г. Amorpha fruticosa – вредоносное инвазионное чужеродное растение в Европе или лекарственное растение от болезней обмена веществ? Передний. Фармакол. 2017 , 8 , 333. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Сигетвари, К. Первые шаги по восстановлению пойменного луга после десятилетия доминирования инвазивного кустарника-трансформера Amorpha fruticosa L. Tiscia 2002 , 33 , 67–77. [ Академика Google ]
- Педашенко, Л.П.; Апостолова, И.И.; Васильев К.В. Невселенность Amorpha fruticosa в различных местообитаниях нижнего Дуная. Фитол. Балк. 2012 , 18 , 285–291. [ Академика Google ]
- Ариануцу, М.; Базос, И.; Делипетру, П.; Коккорис, Ю. Инопланетная флора Греции: таксономия, особенности жизни и предпочтения среды обитания. Биол. Вторжения 2010 , 12 , 3525–3549. [ Академия Google ] [ CrossRef ]
- Самарас, АГ; Коутитас, К.Г. Моделирование воздействия на прибрежную морфологию управления водными ресурсами в трансграничных речных бассейнах: пример реки Нестос. Менеджер. Окружающая среда. Квал. Межд. Дж. 2008 , 19 , 455–466. [ Академия Google ] [ CrossRef ]
- Декамп, Х.; Декамп, О. Средиземноморские прибрежные леса ; Сохранение водно-болотных угодий Средиземноморья; Тур дю Валат: Арль, Франция, 2001 г. [ Google Scholar ]
- Маллинис, Г.; Эмманолудис, Д.; Яннакопулос, В.; Марис, Ф.; Куциас, Н. Картирование и интерпретация исторических изменений растительного покрова/землепользования на участке «Натура 2000» с использованием данных наблюдений за Землей: пример дельты Нестоса, Греция. Прил. геогр. 2011 , 31 , 312–320. [ Академия Google ] [ CrossRef ]
- Дафис, С.; Папастергиаду, Э.; Георгиу, К.; Бабалонас, Д.; Георгиадис, Т.; Папагеоргиу, М.; Лазариду, Т.; Циаусси, В. Греческий проект «среды обитания» Natura 2000: Обзор. Пожизненный контракт B4-32000/94/756 ; Комиссия Европейских Сообществ, Музей естественной истории Гуландриса, Центр греческих биотопов и водно-болотных угодий; Springer: Берлин/Гейдельберг, Германия, 1996. [ Google Scholar ]
- Бьянки, Л.; Пачи, М. Эволюционная динамика и тосканское обучение: Sintesi di quarant'anni di richerche. Для.-Ж. Сильвик. Для. Экол. 2008 , 5 , 122. [ Google Scholar ] [ CrossRef ]
- Векеманс, X.; Боуэнс, Т.; Лемэр, М.; Ролдан-Руис, И. Данные маркеров амплифицированного полиморфизма длин фрагментов (AFLP) указывают на гомоплазию по размеру и взаимосвязь между степенью гомоплазии и размером фрагмента. Мол. Экол. 2002 , 11 , 139–151. [ Академия Google ] [ CrossRef ]
- Пикалл, РОД; Смаус, ЧП Genalex 6: Генетический анализ в Excel. Программное обеспечение популяционной генетики для обучения и исследований. Мол. Экол. Примечания 2006 , 6 , 288–295. [ Академия Google ] [ CrossRef ]
- Тафтсоглу, М.; Валканиотис, С.; Папатанасиу, Г.; Климис, Н.; Докас, И. Подробная карта подверженности разжижению дельты реки Нестос, Фракия, Греция, основанная на поверхностной геологии и геоморфологии. Geosciences 2022 , 12 , 361. [ Академия Google ] [ CrossRef ]
- ДеХаан, Л.; Эльке, Н.; Шиффер, К.; Вайз, Д.; ДеХаан, Р. Оценка разнообразия североамериканских образцов ложного индиго ( Amorpha fruticosa L.) для корма и биомассы. Жене. Ресурс. Кроп Эвол. 2006 , 53 , 1463–1476. [ Академия Google ] [ CrossRef ]
- Ли, М.; Лю, З.; Лю, К.; Чжу, Ф.; Ван, К.; Ван, З.; Ли, Х.; Лан, X.; Гуан, К. Засухоустойчивость табака, сверхэкспрессирующего ген afnac1 Amorpha fruticosa Linn. Передний. Наука о растениях. 2022 , 13 , 980171. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Дат, Северная Каролина; Ли, Дж.-Х.; Лук-порей.; Хонг, Ю.-С.; Ким, Ю.Х.; Ли, Дж. Дж. Фенольные компоненты Amorpha fruticosa , которые ингибируют активацию nf-κb и связанную с ней экспрессию генов. Дж. Нэт. Прод. 2008 , 71 , 1696–1700. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Песня, Ф.; Ци, Д.; Лю, X.; Конг, X.; Гао, Ю.; Чжоу, З.; Ву, К. Протеомный анализ симбиотических белков Glomus mosseae и Amorpha fruticosa . наук. Rep. 2015 , 5 , 18031. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Тодорова Т.; Бояджиев, К.; Шкондров А.; Пырванова П.; Димитрова, М.; Ионкова И.; Крастева И.; Кожухарова Е.; Чанкова, С. Скрининг экстрактов Amorpha fruticosa и Ailanthus altissima на генотоксичность/антигенотоксичность, мутагенность/антимутагенность и канцерогенность/антиканцерогенность. БиоРиск 2022 , 17 , 201–212. [ Академия Google ] [ CrossRef ]
- Цветкович, Д.М.; Йованкич, СП; Милутинович, М.Г.; Никодиевич, Д.Д.; Грбович, Ф.Дж.; Чирич, АР; Топузович, доктор медицинских наук; Маркович, С.Д. Противоинвазивная активность Robinia pseudoacacia L. и Amorpha fruticosa L. На клеточной линии рака молочной железы mda-mb-231. Биология 2019 , 74 , 915–928. [ Академия Google ] [ CrossRef ]
2. Материалы и методы
2.1. Растительный материал
2.2. Процедура ПФЛП
2.3. Индекс регенерации

2.4. Сбор данных и статистический анализ данных AFLP
2.5. Информация о среде обитания 91E0*
3. Результаты
3.1. Генетические результаты



3.2. Плотность и индекс регенерации

4. Дискуссия
5. Выводы
Вклад автора
Финансирование
Заявление о доступности данных
Конфликт интересов
Рекомендации
- Ричардсон, DM; Пышек, П.; Рейманек, М.; Барбур, Миннесота; Панетта, Флорида; Уэст, К.Дж. Натурализация и вторжение чужеродных растений: концепции и определения. Дайверы. Распредел. 2000 , 6 , 93–107. [ Академия Google ] [ CrossRef ]
- Коракаки, Э.; Легакис, А.; Кацаневакис, С.; Кулелис, П.; Аврамиду, Э.; Сулиоти, Н.; Петракис, П. Инвазивные чужеродные виды Греции. Обсервация инвазивных чужеродных видов. Проблемы вокруг света 2021 , 3 , 124–189. [ Академика Google ]
- Мияваки, С.; Вашитани, И. Инвазивные чужеродные виды растений в прибрежных районах Японии: вклад сельскохозяйственных сорняков, видов восстановления растительности и аквакультурных видов. Глоб. Окружающая среда. Рез.-англ. Эд. 2004 , 8 , 89–101. [ Академика Google ]
- Каллауэй, РМ; Ашехуг, Э.Т. Инвазивные растения против их новых и старых соседей: механизм экзотического вторжения. Наука 2000 , 290 , 521–523. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Иванеску, Б.; Лунгу, К.; Власе, Л.; Градинару, AC; Тухилус, К. ВЭЖХ-анализ фенольных соединений, антиоксидантной и противомикробной активности Amorpha fruticosa L. Экстракты. Дж. Плант Дев. 2019 , 26 , 77. [ Академия Google ] [ CrossRef ]
- Штрауб, Южная Каролина; Извините, бакалавр; Уикли, А.С. Amorpha confusa , новое название старой Amorpha (Fabaceae: Amorpheae). Дж. Бот. Рез. Инст. Техас, 2009 г. , 151–155. [ Академика Google ]
- Штрауб, Южная Каролина; Дойл, Дж. Дж. Молекулярная филогенетика Amorpha (Fabaceae): оценка монофилии, видовых отношений и полиплоидного происхождения. Мол. Филогенетика Эвол. 2014 , 76 , 49–66. [ Академия Google ] [ CrossRef ]
- Лю, Дж.; Ван, ET; Chen, WX Разнообразные ризобии, связанные с древесными бобовыми культурами Wisteria sinensis , Cercis Racemosa и Amorpha fruticosa, выращиваемыми в умеренной зоне Китая. Сист. Прил. Микробиол. 2005 , 28 , 465–477. [ Академия Google ] [ CrossRef ]
- Китайский, П. Словарь китайской Materia Medica ; Китайская научно-техническая медицинская пресса: Пекин, Китай, 1997. [ Google Scholar ]
- Митчер, Луизиана; Парк, Ю.Х.; Альшамма, А.; Хадсон, ПБ; Хаас, Т. Аморфрутин a и b, бибензиловые противомикробные средства из Amorpha fruticosa . Фитохимия 1981 , 20 , 781–785. [ Академия Google ] [ CrossRef ]
- Крпан, АП; Томашич, Ж.; Башич Палкович, П. Биопотенциал индигобуша ( Amorpha fruticosa L.) – второй год исследования. Список Шумарского. 2011 , 135 , 103–112. [ Академика Google ]
- Кожухарова Е.; Матковский, А.; Возняк, Д.; Симеонова Р.; Найчов З.; Малайнер, К.; Мокан, А.; Набави, С.М.; Атанасов А.Г. Amorpha fruticosa – вредоносное инвазионное чужеродное растение в Европе или лекарственное растение от болезней обмена веществ? Передний. Фармакол. 2017 , 8 , 333. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Сигетвари, К. Первые шаги по восстановлению пойменного луга после десятилетия доминирования инвазивного кустарника-трансформера Amorpha fruticosa L. Tiscia 2002 , 33 , 67–77. [ Академика Google ]
- Педашенко, Л.П.; Апостолова, И.И.; Васильев К.В. Невселенность Amorpha fruticosa в различных местообитаниях нижнего Дуная. Фитол. Балк. 2012 , 18 , 285–291. [ Академика Google ]
- Ариануцу, М.; Базос, И.; Делипетру, П.; Коккорис, Ю. Инопланетная флора Греции: таксономия, особенности жизни и предпочтения среды обитания. Биол. Вторжения 2010 , 12 , 3525–3549. [ Академия Google ] [ CrossRef ]
- Самарас, АГ; Коутитас, К.Г. Моделирование воздействия на прибрежную морфологию управления водными ресурсами в трансграничных речных бассейнах: пример реки Нестос. Менеджер. Окружающая среда. Квал. Межд. Дж. 2008 , 19 , 455–466. [ Академия Google ] [ CrossRef ]
- Декамп, Х.; Декамп, О. Средиземноморские прибрежные леса ; Сохранение водно-болотных угодий Средиземноморья; Тур дю Валат: Арль, Франция, 2001 г. [ Google Scholar ]
- Маллинис, Г.; Эмманолудис, Д.; Яннакопулос, В.; Марис, Ф.; Куциас, Н. Картирование и интерпретация исторических изменений растительного покрова/землепользования на участке «Натура 2000» с использованием данных наблюдений за Землей: пример дельты Нестоса, Греция. Прил. геогр. 2011 , 31 , 312–320. [ Академия Google ] [ CrossRef ]
- Дафис, С.; Папастергиаду, Э.; Георгиу, К.; Бабалонас, Д.; Георгиадис, Т.; Папагеоргиу, М.; Лазариду, Т.; Циаусси, В. Греческий проект «среды обитания» Natura 2000: Обзор. Пожизненный контракт B4-32000/94/756 ; Комиссия Европейских Сообществ, Музей естественной истории Гуландриса, Центр греческих биотопов и водно-болотных угодий; Springer: Берлин/Гейдельберг, Германия, 1996. [ Google Scholar ]
- Бьянки, Л.; Пачи, М. Эволюционная динамика и тосканское обучение: Sintesi di quarant'anni di richerche. Для.-Ж. Сильвик. Для. Экол. 2008 , 5 , 122. [ Google Scholar ] [ CrossRef ]
- Векеманс, X.; Боуэнс, Т.; Лемэр, М.; Ролдан-Руис, И. Данные маркеров амплифицированного полиморфизма длин фрагментов (AFLP) указывают на гомоплазию по размеру и взаимосвязь между степенью гомоплазии и размером фрагмента. Мол. Экол. 2002 , 11 , 139–151. [ Академия Google ] [ CrossRef ]
- Пикалл, РОД; Смаус, ЧП Genalex 6: Генетический анализ в Excel. Программное обеспечение популяционной генетики для обучения и исследований. Мол. Экол. Примечания 2006 , 6 , 288–295. [ Академия Google ] [ CrossRef ]
- Тафтсоглу, М.; Валканиотис, С.; Папатанасиу, Г.; Климис, Н.; Докас, И. Подробная карта подверженности разжижению дельты реки Нестос, Фракия, Греция, основанная на поверхностной геологии и геоморфологии. Geosciences 2022 , 12 , 361. [ Академия Google ] [ CrossRef ]
- ДеХаан, Л.; Эльке, Н.; Шиффер, К.; Вайз, Д.; ДеХаан, Р. Оценка разнообразия североамериканских образцов ложного индиго ( Amorpha fruticosa L.) для корма и биомассы. Жене. Ресурс. Кроп Эвол. 2006 , 53 , 1463–1476. [ Академия Google ] [ CrossRef ]
- Ли, М.; Лю, З.; Лю, К.; Чжу, Ф.; Ван, К.; Ван, З.; Ли, Х.; Лан, X.; Гуан, К. Засухоустойчивость табака, сверхэкспрессирующего ген afnac1 Amorpha fruticosa Linn. Передний. Наука о растениях. 2022 , 13 , 980171. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Дат, Северная Каролина; Ли, Дж.-Х.; Лук-порей.; Хонг, Ю.-С.; Ким, Ю.Х.; Ли, Дж. Дж. Фенольные компоненты Amorpha fruticosa , которые ингибируют активацию nf-κb и связанную с ней экспрессию генов. Дж. Нэт. Прод. 2008 , 71 , 1696–1700. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Песня, Ф.; Ци, Д.; Лю, X.; Конг, X.; Гао, Ю.; Чжоу, З.; Ву, К. Протеомный анализ симбиотических белков Glomus mosseae и Amorpha fruticosa . наук. Rep. 2015 , 5 , 18031. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Тодорова Т.; Бояджиев, К.; Шкондров А.; Пырванова П.; Димитрова, М.; Ионкова И.; Крастева И.; Кожухарова Е.; Чанкова, С. Скрининг экстрактов Amorpha fruticosa и Ailanthus altissima на генотоксичность/антигенотоксичность, мутагенность/антимутагенность и канцерогенность/антиканцерогенность. БиоРиск 2022 , 17 , 201–212. [ Академия Google ] [ CrossRef ]
- Цветкович, Д.М.; Йованкич, СП; Милутинович, М.Г.; Никодиевич, Д.Д.; Грбович, Ф.Дж.; Чирич, АР; Топузович, доктор медицинских наук; Маркович, С.Д. Противоинвазивная активность Robinia pseudoacacia L. и Amorpha fruticosa L. На клеточной линии рака молочной железы mda-mb-231. Биология 2019 , 74 , 915–928. [ Академия Google ] [ CrossRef ]
- Категория: Блог
- Просмотров: 481
Абстрактный
1. Введение
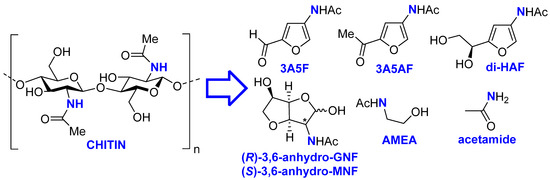
2. Материалы и методы
2.1. Общая информация
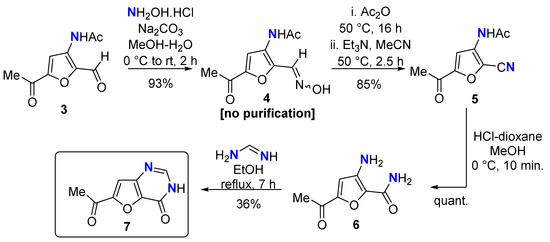
2.1.1. 2-Гидроксиимино-3-ацетамидо-5-ацетилфуран ( 4 )
2.1.2. 2-Циано-3-ацетамидо-5-ацетилфуран ( 5 )
2.1.3. 5-Ацетил-3-амино-2-карбоксамидофуран ( 6 )
2.1.4. 6-Ацетилфуро[3,2-d]пиримидин-4-он ( 7 )
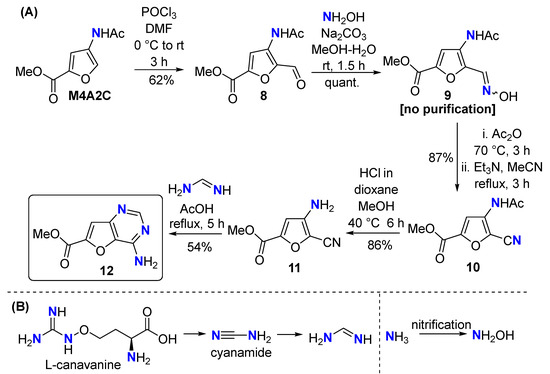
2.1.5. Метил 4-ацетамидо-5-формилфуран-2-карбоксилат ( 8 )
2.1.6. Метил 4-ацетамидо-5-[(гидроксиимино)метил]фуран-2-карбоксилат ( 9 )
2.1.7. Метил 4-ацетамидо-5-цианофуран-2-карбоксилат ( 10 )
2.1.8. Метил 4-амино-5-цианофуран-2-карбоксилат ( 11 )
2.1.9. Метил 4-аминофуро[3,2-d]пиримидин-6-карбоксилат ( 12 )
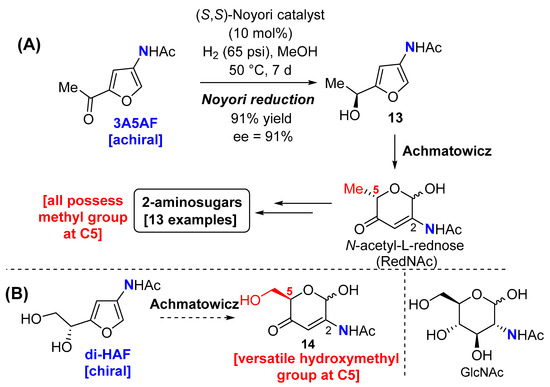
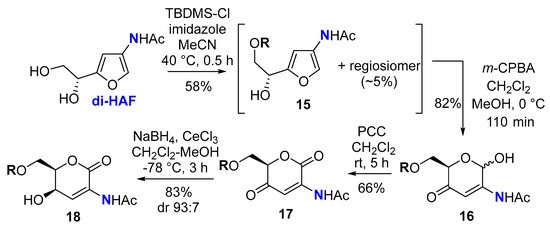
2.1.10. ( R )- N -(5-(2-(( трет- Бутилдиметилсилил)окси)-1-гидроксиэтил)фуран-3-ил)ацетамид ( 15 )
2.1.11. N -((6 R )-6-((( трет- Бутилдиметилсилил)окси)метил)-2-гидрокси-5-оксо-5,6-дигидро-2Н-пиран-3-ил)ацетамид ( 16 )
2.1.12. ( R )- N -(6-((( трет- Бутилдиметилсилил)окси)метил)-2,5-диоксо-5,6-дигидро-2 H -пиран-3-ил)ацетамид ( 17 )
2.1.13. N -((5R , 6R ) -6-((( трет- Бутилдиметилсилил)окси)метил)-5-гидрокси-2-оксо-5,6-дигидро-2Н-пиран-3-ил)ацетамид ( 18 )
3. Результаты и их обсуждение
Дополнительные материалы
Вклад автора
Финансирование
Заявление о доступности данных
Благодарности
Конфликт интересов
Рекомендации
- Кириаку, В.; Гарагунис, И.; Вуррос, А.; Василейу, Э.; Стукидес, М. Электрохимический процесс Габера-Боша. Джоуль 2020 , 4 , 142–158. [ Академия Google ] [ CrossRef ]
- Песня, X.; Башир, К.; Заре Р.Н. Получение аммиака из микрокапель азота и воды. Учеб. Натл. акад. наук. США 2023 , 120 , e2301206120. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Соловейчик Г. Электрохимический синтез аммиака как потенциальная альтернатива процессу Габера – Боша. Нат. Катал. 2019 , 2 , 377–380. [ Академия Google ] [ CrossRef ]
- Ван, М.; Хан, Массачусетс; Мохсин, И.; Уикс, Дж.; ИП, АХ; Сумон, Казахстан; Динь, Коннектикут; Сарджент, Э. Х.; Гейтс, ID; Голам Кибрия, М. Могут ли устойчивые пути синтеза аммиака конкурировать с процессами Габера-Боша на основе ископаемого топлива? Энергетическая среда. наук. 2021 , 14 , 2535–2548. [ Академия Google ] [ CrossRef ]
- Ян, Н.; Чен, X. Устойчивое развитие: не выбрасывайте отходы морепродуктов. Природа 2015 , 524 , 155–157. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Халси, MJ; Ян, Х.; Ян, Н. Устойчивые пути синтеза возобновляемых химикатов, содержащих гетероатомы. АСУ Сустейн. хим. англ. 2018 , 6 , 5694–5707. [ Академия Google ] [ CrossRef ]
- Дай, Дж.; Ли, Ф.; Фу, X. На пути к биопереработке Shell: достижения в химико-каталитической конверсии хитиновой биомассы в азоторганические химикаты. ChemSusChem 2020 , 13 , 6498–6508. [ Академия Google ] [ CrossRef ]
- Осада, М.; Кикута, К.; Ёсида, К.; Тотани, К.; Огата, М.; Усуи, Т. Некаталитический синтез хромогенов I и III из N-ацетил-D-глюкозамина в высокотемпературной воде. Зеленая химия. 2013 , 15 , 2960–2966. [ Академия Google ] [ CrossRef ]
- Течикавара, К.; Кобаяши, Х.; Фукуока, А. Превращение N-ацетилглюкозамина в защищенную аминокислоту на катализаторе Ru/C. АСУ Сустейн. хим. англ. 2018 , 6 , 12411–12418. [ Академия Google ] [ CrossRef ]
- Боббинк, Флорида; Чжан, Дж.; Пирсон, Ю.; Чен, X.; Ян, Н. Превращение производного хитина N-ацетил-D-глюкозамина (NAG) в полиолы с использованием катализаторов на основе переходных металлов и водорода в воде. Зеленая химия. 2015 , 17 , 1024–1031. [ Академия Google ] [ CrossRef ]
- Никахд, М.; Микусек, Дж.; Ю, Л.-Ж.; Кут, ML; Банвелл, Миннесота; Ма, К.; Гардинер, М.Г. Использование хитина как источника биологически фиксированного азота: образование и полная характеристика низкомолекулярных гетеро- и карбоциклических продуктов пиролиза. Дж. Орг. хим. 2020 , 85 , 4583–4593. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Банвелл, Миннесота; Поллард, Б.; Лю, X.; Коннал, Лос-Анджелес. Использование самых распространенных в природе полимеров: разработка новых путей преобразования целлюлозы, гемицеллюлозы, лигнина и хитина в платформенные молекулы (и за их пределами). хим. Азиатский журнал, 2021 , 16 , 604–620. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Гомес, РФА; Гонсалвеш, BMF; Андраде, KHS; Соуза, BB; Маулид, Н.; Бернард, GJL; Афонсо, CAM Раскрытие потенциала фурановых платформ на биологической основе, богатых азотом, в качестве синтонов биомассы. Энджью. хим. Межд. Эд. 2023 , 62 , e202304449. [ Академия Google ] [ CrossRef ]
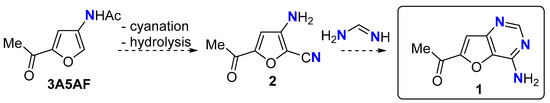
- Падован, Д.; Кобаяши, Х.; Фукуока, А. Простое получение 3-ацетамидо-5-ацетилфурана из N-ацетил-d-глюкозамина с использованием коммерчески доступных солей алюминия. ChemSusChem 2020 , 13 , 3594–3598. [ Академия Google ] [ CrossRef ] [ PubMed ]
- ван дер Лоо, CHM; Борст, MLG; Паувер, К.; Миннаард, А.Дж. Дегидратация N-ацетилглюкозамина (GlcNAc) до энантиочистого дигидроксиэтилацетамидофурана (Di-HAF). Орг. Биомол. хим. 2021 , 19 , 10105–10111. [ Академия Google ] [ CrossRef ]
- Садик, AD; Чен, X.; Ян, Н.; Сперри, Дж. На пути к биоперерабатывающему заводу Shell: устойчивый синтез противоракового алкалоида проксимицина А из хитина. ChemSusChem 2018 , 11 , 532–535. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Фам, ТТ; Линдси, AC; Чен, X.; Гезайдин, Г.; Ян, Н.; Сперри, Дж. Перенос биовозобновляемого азота, присутствующего в хитине, в несколько N-функциональных групп. Поддерживать. хим. Фарм. 2019 , 13 , 100143. [ Академия Google ] [ CrossRef ]
- Фам, ТТ; Линдси, AC; Ким, Южный-Западный; Перселло, Л.; Чен, X.; Ян, Н.; Сперри, Дж. Двухэтапное получение разнообразных 3-амидофуранов из хитина. ChemistrySelect 2019 , 4 , 10097–10099. [ Академия Google ] [ CrossRef ]
- Фам, ТТ; Чен, X.; Ян, Н.; Сперри, Дж. Новый дигидродифуропиридиновый каркас, полученный из кетонов и гетероцикла, полученного из хитина, 3-ацетамидо-5-ацетилфурана. Монатш. хим. 2018 , 149 , 857–861. [ Академия Google ] [ CrossRef ]
- Фам, ТТ; Гезайдин, Г.; Зёнель, Т.; Ян, Н.; Сперри, Дж. Окислительное расширение кольца платформы, полученной из хитина, обеспечивает доступ к неизведанному химическому пространству 2-аминосахаров. Евро. Дж. Орг. хим. 2019 , 2019 , 1355–1360. [ Академия Google ] [ CrossRef ]
- Фам, ТТ; Чен, X.; Зёнель, Т.; Ян, Н.; Сперри, Дж. Хабер-независимый, ориентированный на разнообразие синтез азотных соединений из биовозобновляемого хитина. Зеленая химия. 2020 , 22 , 1978–1984. [ Академия Google ] [ CrossRef ]
- Невилл, Джей Си; Лау, МОЙ; Зёнель, Т.; Сперри, Дж. Хабер-Независимый асимметричный синтез морского алкалоида эпи-лептосферина из синтона хирального пула, полученного из хитина. Орг. Биомол. хим. 2022 , 20 , 6562–6565. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Перейра, Дж.Г.; Раваско, JMJM; Вейл, младший; Кведа, Ф.; Гомес, RFA Прямая реакция Дильса-Альдера с получением 3-ацетамидо-5-ацетилфурана из хитина. Зеленая химия. 2022 , 24 , 7131–7136. [ Академия Google ] [ CrossRef ]
- Сантос, CS; Родини Маттиоли, Р.; Соарес Баптиста, Ж.; Менезес да Силва, В.Х.; Браун, DL; Пастре, Дж. К. Азотированные ароматические соединения из хитина. Зеленая химия. 2023 , 25 , 5059–5067. [ Академия Google ] [ CrossRef ]
- ван дер Лоо, CHM; Шим ван дер Лофф, Р.; Мартин, А.; Гомес-Сал, П.; Борст, MLG; Паувер, К.; Миннаард, А.Дж. π-фациальная селективность в реакции Дильса-Альдера хиральных фуранов и малеимидов на основе глюкозамина. Орг. Биомол. хим. 2023 , 21 , 1888–1894. [ Академия Google ] [ CrossRef ]
- Икегами, С.; Исомура, Х.; Цучимори, Н.; Хамада, К.; КОБАЯСИ, Х.; Кодзима, Ю.; Осано, Ю.Т; Кумадзава, С.; Мацузаки, Т. Кристаллическая структура ингибитора эмбрионального развития морских звезд, 4-оксо-7-(β-D-рибофуранозил)-3H-фуро[3, 2-d]пиримидин: пересмотр структуры пирролозина. Анальный. наук. 1992 , 8 , 897–898. [ Академия Google ] [ CrossRef ]
- Бхаттачарья, БК; Лим, М.-И.; Выдра, бакалавр искусств; Кляйн, Р.С. Синтез фуро[3,2-d]пиримидиновых нуклеозидов: новый c-нуклеозидный изостер аденозина. Тетраэдр Летт. 1986 , 27 , 815–818. [ Академия Google ] [ CrossRef ]
- Бхаттачарья, БК; Выдра, бакалавр искусств; Беренс, РЛ; Кляйн, Р.С. Исследования по синтезу фуро[3,2-d]пиримидин-С-нуклеозидов: новые аналоги инозина с антипротозойной активностью. Нуклеозиды Нуклеотиды 1990 , 9 , 1021–1043. [ Академия Google ] [ CrossRef ]
- Хоеманн, М.; Уилсон, Н.; Аргириади, М.; Банах, Д.; Бурчат, А.; Колдервуд, Д.; Клэпхэм, Б.; Кокс, П.; Дуиньян, Д.Б.; Конопацкий, Д.; и другие. Синтез и оптимизация фурано[3,2-d]пиримидинов как селективных ингибиторов тирозинкиназы селезенки (Syk). Биоорг. Мед. хим. Летт. 2016 , 26 , 5562–5567. [ Академия Google ] [ CrossRef ]
- Кошизава, Т.; Моримото, Т.; Ватанабэ, Г.; Ватанабэ, Т.; Ямасаки, Н.; Савада, Ю.; Фукуда, Т.; Окуда, А.; Сибуя, К.; Огия, Т. Оптимизация новой серии мощных и перорально биодоступных агонистов GPR119. Биоорг. Мед. хим. Летт. 2017 , 27 , 3249–3253. [ Академия Google ] [ CrossRef ]
- Хэнкокс, Техас; Пегг, Северная Каролина; Надин, Эй Джей; Прайс, С. Фармацевтические соединения. Патент WO2008152394, 12 июня 2008 г. [ Google Scholar ]
- Роудс, Дж.; Майдолл, М.; Цой, И.Ю.; Копец Б. Методы и лечение вирусной инфекции замещенными фуро-пиримидинами. Патент WO2022261068, 8 июня 2021 г. [ Google Scholar ]
- Ким, С.; Хонг, Дж. Х. Синтез новых 4'-трифторметил-5'-норкарбоциклических C-нуклеозидфосфоновых кислот в качестве мощных противолейкемических средств. Нуклеозиды Нуклеотиды Нуклеиновые Кислоты 2015 , 34 , 848–865. [ Академия Google ] [ CrossRef ]
- Бутора, Г.; Олсен, Д.Б.; Кэрролл, СС; МакМастерс, доктор медицинских наук; Шмитт, К.; Леоне, Дж. Ф.; Сталхут, М.; Бурлейн, К.; МакКосс, М. Синтез и ингибирующие ВГС свойства 9-деаза- и 7,9-дидеаза-7-окса-2'-C-метиладенозина. Биоорг. Мед. хим. 2007 , 15 , 5219–5229. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Шелдрик, генеральный директор Краткая история SHELX. Акта Кристаллогр. Секта. А, 2008 , 64 , 112–122. [ Академия Google ] [ CrossRef ]
- Бурхис, LJ; Доломанов О.В.; Гильдеа, Р.Дж.; Ховард, JAK; Пушманн, Х. Анатомия комплексной ограниченной программы усовершенствования современной вычислительной среды - анализ Olex2. Акта Кристаллогр. Секта. А 2015 , 71 , 59–75. [ Академия Google ] [ CrossRef ]
- Доломанов О.В.; Бурхис, LJ; Гильдеа, Р.Дж.; Ховард, JAK; Пушманн, Х. OLEX2: Полное структурное решение, программа уточнения и анализа. Дж. Прил. Кристаллогр. 2009 , 42 , 339–341. [ Академия Google ] [ CrossRef ]
- Макрэ, CF; Соваго, И.; Коттрелл, С.Дж.; Галек, ОТА; Маккейб, П.; Пидкок, Э.; Платингс, М.; Шилдс, врач общей практики; Стивенс, Дж. С.; Таулер, М.; и другие. Меркурий 4.0: от визуализации к анализу, проектированию и прогнозированию. Дж. Прил. Кристаллогр. 2020 , 53 , 226–235. [ Академия Google ] [ CrossRef ]
- Теоклиту, М.-Э.; Акила, Б.; Блок, Миннесота; Бразил, ПиДжей; Кастриотта, Л.; Код, Э.; Коллинз, член парламента; Дэвис, AM; Диган, Т.; Эжутачан, Дж.; и другие. Открытие (+)-N-(3-аминопропил)-N-[1-(5-бензил-3-метил-4-оксо-[1,2]тиазоло[5,4-d]пиримидин-6-ил )-2-метилпропил]-4-метилбензамид (AZD4877), ингибитор белка кинезинового веретена и потенциальный противораковый агент. Дж. Мед. хим. 2011 , 54 , 6734–6750. [ Академия Google ] [ CrossRef ] [ PubMed ]
- О'Дауд, ЧР; Хелм, доктор медицины; Раунтри, JSS; Флаз, Дж. Т.; Аркудис, Э.; Миэль, Х.; Хьюитт, PR; Джордан, Л.; Баркер, О.; Хьюз, К.; и другие. Идентификация и структурно-ориентированная разработка ингибиторов USP7 на основе пиримидинона. АКС Мед. хим. Летт. 2018 , 9 , 238–243. [ Академия Google ] [ CrossRef ]
- Чжан, Д.; Ли, В.; Хуанг, X.; Цинь, В.; Лю, М. Удаление аммония из поверхностных вод при низкой температуре недавно выделенной микробактерией Sp. Штамм SFA13. Биоресурс. Технол. 2013 , 137 , 147–152. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Одо, К.; Итикава, Э.; Шираи, К.; Сугино, К. Примечания — новый метод получения формамидина. Дж. Орг. хим. 1957 , 22 , 1715. [ Google Scholar ] [ CrossRef ]
- Камо, Т.; Хирадате, С.; Фуджи, Ю. Первое выделение природного цианамида как возможного аллелохимического вещества из вики волосатой Vicia Villosa. Дж. Хим. Экол. 2003 , 29 , 275–283. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Камо, Т.; Сакурай, С.; Яманаси, Т.; Тодороки, Ю. Цианамид биосинтезируется из L-канаванина в растениях. наук. Rep. 2015 , 5 , 10527. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Браун, DJ Новый синтез формамидина. Дж. Прил. хим. 1952 , 2 , 202–203. [ Академия Google ] [ CrossRef ]
- Пфрэнгл, Ф.; Рейссиг, Х.-У. Аминосахара и их миметики через 1,2-оксазины. хим. Соц. Ред. 2010 г. , 39 , 549–557. [ Академия Google ] [ CrossRef ] [ PubMed ]
- Эммади, М.; Кулкарни, С.С. Последние достижения в синтезе бактериальных строительных блоков редких сахаров и их применения. Нат. Прод. Республика 2014 , 31 , 870–879. [ Академия Google ] [ CrossRef ]
- Скарбек, К.; Милевска, М.Дж. Биосинтетический и синтетический доступ к аминосахарам. Углевод. Рез. 2016 , 434 , 44–71. [ Академия Google ] [ CrossRef ]
- Ян, Дж.; Се, Д.; Ма, X. Последние достижения в химическом синтезе аминосахаров. Молекулы 2023 , 28 , 4724. [ Академика Google ] [ CrossRef ]
- Категория: Блог
- Просмотров: 584
Гиперспектральные изображения пластмасс и фильтрующих подложек были собраны в виде кубов данных в БИК-диапазоне (900-1700 нм) с использованием настольной системы HSI с геометрией отражения.
-1000x400.jpg)
Загрязнение микропластиком стало актуальной проблемой, поскольку оно негативно влияет на экосистемы.Однако эффективные методы обнаружения и характеристики микропластичных частиц все еще находятся в разработке. четкие спектральные характеристики при 1150-1250 нм, 1350-1450 нм и 1600-1700 нм, что позволяет их автоматическое распознавание и идентификацию с помощью алгоритмов спектрального разделения. Используя улучшенную систему гиперспектральной визуализации, мы продемонстрировали обнаружение трех типов микропластичных частиц: полиэтилена, полипропилена и полистирола диаметром до 100 мкм
В диапазоне длин волн 900-1700 нм 11 подлинных образцов пластикового полимера продемонстрировали отличительные характеристики поглощения в трех конкретных диапазонах длин волн: 1150-1250 нм, 1350-1450 нм и 1600-1700 нм. Различные пластиковые полимеры демонстрировали, по-видимому, разные спектральные характеристики. В частности, полиэтилен, наиболее широко используемый пластиковый полимер с наибольшим годовым производством, показал две основные характеристики поглощения при 1195-1225 нм и 1385-1420 нм, сопровождающиеся двумя другими отклонениями от базового уровня при 1150 нм и 1550 нм. ПП показал различные схемы отражения при 1185-1230 нм и 1390-1420 нм. Для сравнения, спектры PS и ABS имели схожие характерные особенности при ∼1130-1160 нм, 1195-1215 нм и 1400-1420 нм. Результаты исследования основных спектральных характеристик PE, PP и PS показали дополнительные различимые особенности с более высоким разрешением по длине волны при 2,5 нм по сравнению с 12 нм и 10 нм.
- Категория: Блог
- Просмотров: 610
Гиперспектральные изображения используются для обнаружения утечки нефти и определения ее характерных особенностей, и тогда успех распространения или смягчения последствий предопределен.
Гиперспектральные изображения используются для обнаружения утечки нефти и определения ее характерных особенностей, и тогда успех распространения или смягчения последствий предопределен. Шаги для достижения этой цели следующие:
a. Прогнозирование направления распространения разлива нефти и характеристик расхода
Анализ гиперспектральных изображений разлива нефти должен проводиться вовремя для оперативного мониторинга окружающей среды
. Анализируя временное изображение HSI в воздухе, мы можем предсказать, как разлив нефти распространится по водным
объектам, исходя из текущих условий окружающей среды и какие чувствительные участки могут быть затронуты.
б. Реорганизация свойств и интенсивности береговой линии разлива нефти
HSI с высоким спектральным и пространственным разрешением может использоваться для обнаружения свойств береговой линии и
областей, разрушенных из-за утечки нефти. Необходимо исследовать затронутые экологически чувствительные районы, включая заболоченные территории
с мелководьем, водорослями, солончаками, приливными равнинами, каналами или песчаными береговыми линиями с замечательным
биоразнообразием, поскольку эти районы экологически чувствительны.
c. Определение типа загрязняющего вещества
По характерным признакам нефти (e.например, типы нефти и уровень концентрации) важны и могут быть использованы для выбора наилучшего метода очистки, для оценки
экологических последствий сжигания нефти и для моделирования явлений утечки нефти (таких как прогнозирование пути потока, скоростей рассеивания и времени до того, как пятно достигнет берега). Например, скорость испарения легкой нефти выше по сравнению с сырой нефтью, в то время как она может быть более ядовитой для различных морских видов.
- Категория: Блог
- Просмотров: 727
Методика подготовки рентгенофлуоресцентного спектрального анализа. После сушки, измельчения и перемешивания порошок смешивают с флюсом, помещают в специальный тигель (сплав Pt 95%, Au 5%), с 1000 до 1200 град С высокотемпературный нагрев и плавление, после охлаждения до получения однородной, гладкой и образцы плоского стекла. Существует четыре широко используемых флюса: безводный борат лития и метаборат лития или их смесь в соответствии с определенной пропорцией смешанного флюса и т. д.
Иногда добавляют флюс, такой как безводная литий-борная кислота, метаборат лития или их смесь в соответствии с определенной пропорцией смеси, и добавляют небольшое количество разделительного агента, такого как бромид аммония, бромид лития, йодид калия и т. д. Типы и требования к анализу качества и выбору образца и коэффициенту потока температуры плавления в качестве образца. Прототип имеет высокочастотный и электрический нагрев. Устранено влияние размера частиц, минерального и структурного влияния на размер частиц, минеральное и структурное влияние в рентгенофлуоресцентном анализе, повышена точность и достоверность основных и второстепенных элементов (особенно легких элементов).
Кроме того, в соответствии с расплавленным образцом калибровочные образцы были приготовлены с использованием реагента высокой чистоты в определенной пропорции, чтобы решить проблему отсутствия стандартного материала в некоторых видах образцов. Большое количество производственных процессов из-за потока разбавления, элементного анализа увеличивает интенсивность линии и снижает фоновую интенсивность, для микроэлементов (особенно микроэлементов) и предела обнаружения.

Страница 9 из 30
